



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




美迪西建立了完善的杂质制备及结构鉴定分析平台,可以为客户提供包括药物杂质定向合成、杂质制备、对照品标化、杂质结构鉴定等一站式服务。我们的药物杂质制备和结构确证团队可以运用丰富的制备设备和多种先进的分析技术(NMR、LC-MS/MS、HRMS、双三元质谱等),为客户提供不同数量级、满足研发纯度要求的杂质样品,为客户杂质研究和杂质控制提供支持,并且可以提供符合CTD要求的结构确证解析报告,从而帮助客户完成产品的申报和顺利获批。
杂质是药品的关键质量属性,杂质研究不充分会对药品的安全性和有效性造成潜在风险,相对而言,完整的杂质研究和充分的杂质控制是药品成功获批的重要因素之一,因此杂质研究是贯穿工艺研究始终的重要内容。
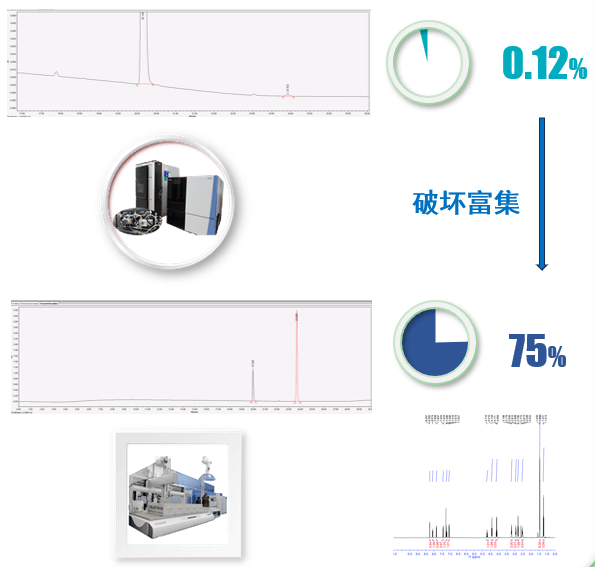
而杂质研究的难点聚焦于在生产过程中产生的未知顽固杂质以及在稳定性研究过程中产生的未知降解杂质,这些杂质产生的机理往往较为复杂,又因为结构未知,其产生途径难以判断,并且在大部分情况下杂质的含量又很低,难以通过常规的化学方法进行富集和纯化,这种情况下制备液相技术就成为了解决问题的利器。
 杂质制备及结构鉴定分析平台
杂质制备及结构鉴定分析平台
Agilent1260液相配备馏分收集器模块,具备HPLC同等的分离能力和重现性,搭配馏分收集器,精准收集任意目标杂质,减少样品浪费,适合样品宝贵,含量低,分离难度较大的样品。

Gilson制备液相色谱配备双波长UV检测器,峰型优越,具备快速制备和分离色谱技术,该设备采用图形化界面,可以轻松地编写方法,调整参数,收集馏分次数无上限。

Waters制备液相色谱采用双泵模式,配备UV、ELSD、MS检测器,能精准检测化合物中各个成分,适用范围更广,可采取ELSD或MS进行制备,同时可以对所收杂质进行鉴别。

 美迪西杂质制备及结构鉴定分析服务流程
美迪西杂质制备及结构鉴定分析服务流程客户提供项目相关资料,美迪西进行项目核算并提供报价合同
签订服务合同后项目开始实施,对杂质谱进行分析井制定杂质研究策略。
对制备产品进行含量赋值以及结构确证NMR、HRMS
根据检测结果出具符合CTD要求的结构确证解析报告帮助客户产品完成申报和顺利获批。
 杂质制备及结构鉴定分析服务项目
杂质制备及结构鉴定分析服务项目提供原料、中间体、原料药和制剂中的杂质定向合成服务
提供原料、中间体、原料药和制剂中的杂质制备分离服务
提供工艺杂质、降解杂质等结构鉴定和分析服务
提供原料、中间体、原料药和制剂中的杂质定性研究服务
提供原料药和制剂中降解杂质的分离、制备服务
提供杂质的对照品标化以及含量赋值等服务
 案例分享
案例分享


 “杂质制备及结构鉴定分析”相关视频推荐
“杂质制备及结构鉴定分析”相关视频推荐 相关实验室
相关实验室






