 PROTAC技术作用机制
PROTAC技术作用机制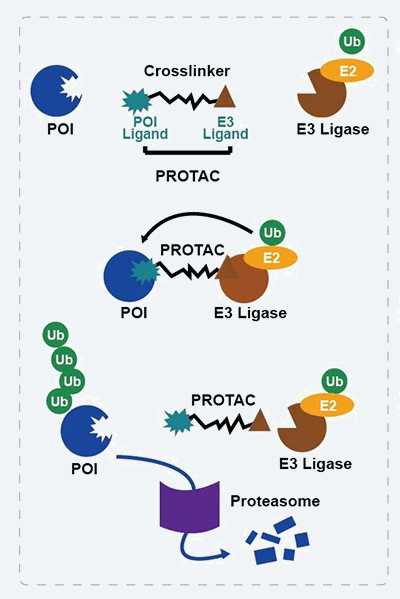
1.PROTAC分子通过其一端的靶蛋白配体(POI Ligand)特异性识别并结合靶蛋白,通过其另一端的E3泛素连接酶配体(E3 Ligase Ligand)特异性识别并结合E3 Ligase;
2.形成P O I - P R O T A C - E3 ligase三元复合体;
3. 在此三元复合体中,靶蛋白POI被E3 ligase泛素化修饰,泛素化修饰了的POI随后被蛋白酶体识别并降解,由此抑制靶蛋白的功能。
 PROTAC技术优势
PROTAC技术优势- 改变靶点的“不可成药性”(undruggable)PROTAC的作用分子机制是通过泛素-蛋白酶体系统降解靶蛋白,并非通过竞争结合以封闭靶蛋白功能区而发挥蛋白功能抑制作用,因此PROTAC对靶蛋白识别结合区不一定非得是活性区,结合力也不一定必须是高亲和力;这使得一些缺乏高亲和力小分子结合的“不可成药性”靶蛋白变成“可成药性”。
- 高效性传统小分子抑制剂通过竞争结合靶蛋白活性功能域而抑制靶蛋白功能,所需小分子的量往往较大;而PROTAC通过泛素-蛋白酶体系统降解靶蛋白以解除靶蛋白功能,故具有可循环使用性、用量低和高效性的特点。
- 无免疫原性与抗体药物相比,PROTAC不会引发抗药抗体产生。
 美迪西PROTAC技术服务
美迪西PROTAC技术服务- PROTAC设计合成美迪西有着多年的PROTAC合成经验,汇总了当前热门的多种POI配体,不同组织类型的E3 Ligase配体,并且建立了含数百种连接分子的Linker库。此外,美迪西成熟的计算机辅助药物设计技术平台,大大提高PROTAC的设计合成质量。美迪西已经验证的PROTAC靶点有:IRAK4, AR, ER, IKZF1, IKZF2, IKZF3, BTK, EGFR, BRD4, BCL-xL, CDK4, CDK6, SMARCA2, SMARCA4, AKT, ALK, STAT3, SHP2, FGFR1, FGFR2, KRAS G12C, KRAS G12D等。
- PROTAC体外研究美迪西案例:HiBiT-标签-POI 稳转细胞株高通量筛选:利用基因敲入技术构建的“内源蛋白-HiBiT”稳转株细胞,对PROTAC分子进行高通量筛选,计算DC50。
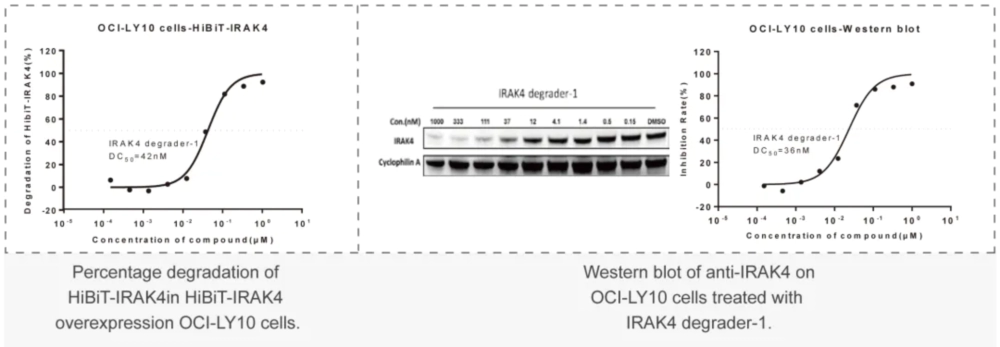 美迪西案例:Western Blot或者In-cell Western:通过WB实验检测初筛到的PROTAC分子对靶标蛋白的降解能力,分析DC50值。
美迪西案例:Western Blot或者In-cell Western:通过WB实验检测初筛到的PROTAC分子对靶标蛋白的降解能力,分析DC50值。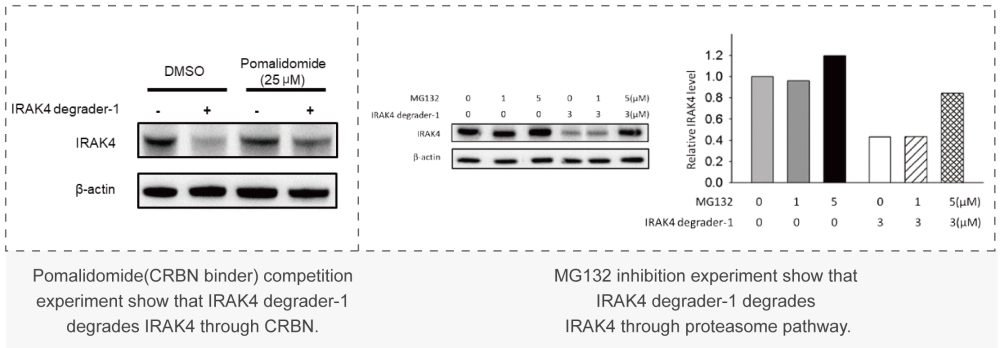 美迪西案例:细胞毒性实验(CCK-8或CTG法):检测上述筛选到PROTAC对癌细胞增殖抑制能力,分析IC50值。
美迪西案例:细胞毒性实验(CCK-8或CTG法):检测上述筛选到PROTAC对癌细胞增殖抑制能力,分析IC50值。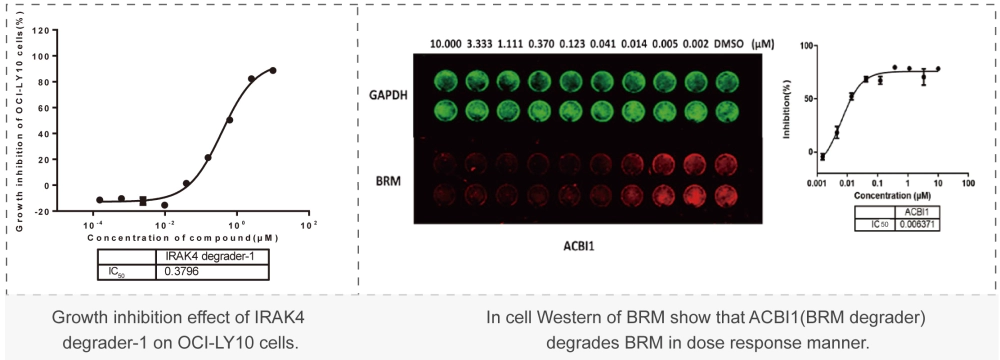
美迪西建立了完整的PROTAC体外分析平台,其主要服务内容包括二元及三元复合物形成分析、靶点泛素化分析以及靶点降解水平分析。这些服务内容涵盖了从蛋白水平到细胞水平的多种检测方法,能够为客户提供全面且高效的PROTAC分子体外评价解决方案。
如果您对PROTAC体外分析技术感兴趣,请立即联系我们,获取解决方案。
- PROTAC体内药理药效研究
美迪西药理药效部紧跟行业发展与市场需求,不断完善创新,经过多年的经验累积,多方验证和长期实践考验,建立了完善的动物模型库,可根据客户的需求提供各种有效的动物模型,用来检测药物的有效性。实验动物有非人灵长类动物、犬、大小鼠、兔、豚鼠、小型猪等种类。美迪西已建立440+种肿瘤评价模型,为多种创新疗法赋能。
美迪西案例: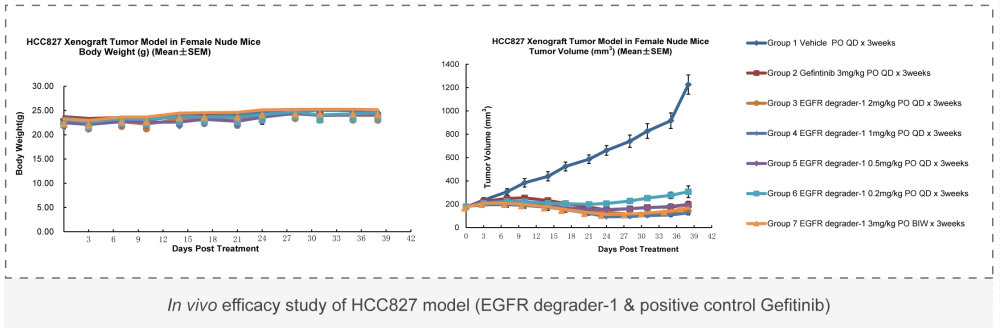
- PROTAC药代动力学评价美迪西DMPK团队,通过PROTAC技术原理,结合研发案例,利用完善的体外 ADME、体内PK测试平台,在小分子化合物研究基础上,建立起一套关于PROTAC药物的筛选和IND评价体系,关注药物的溶解度、渗透性、代谢稳定性、代谢产物鉴定与体内PK研究等,帮助客户快速推进PROTAC药物的研发。美迪西案例:下文中科研人员使用Thalidomide募集Cereblon/cullin 4A E3连接酶并通过 Linker进行固化,在小鼠中发现了具有良好口服药代动力学特性的高效AR降解剂 ARD-2128。

在此项研究中,科研人员通过美迪西评估了五种高效AR降解剂在小鼠中静脉和口服给药的药代动力学 (PK) 数据,其中最优化合物为ARD-2128。PK数据显示,ARD-2128具有出色的整体PK曲线:低清除率 (1.2 mL/min/kg) 和中高稳态分布容积 (Vss为2.7 L/kg)。ARD-2128按2 mg/kg剂量静脉给药后的T1/2为27.6小时,按5 mg/kg剂量口服给药后T1/2为18.8小时。ARD-2128 (5 mg/kg) 在小鼠体内达到67%的口服生物利用度,通过口服给药有效降低AR蛋白并抑制肿瘤组织中的AR调节基因,从而有效抑制小鼠肿瘤生长且无毒性迹象。
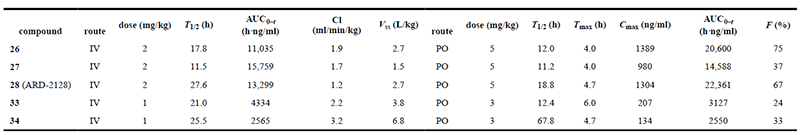 五种化合物在雄性 ICR 小鼠中的 PK 数据汇总[1]此外,科研人员通过美迪西测试了ARD-2128在小鼠、大鼠、犬、猴和人五种属中的血浆稳定性。数据显示ARD-2128在所有五种属中都具有稳定的血浆稳定性。
五种化合物在雄性 ICR 小鼠中的 PK 数据汇总[1]此外,科研人员通过美迪西测试了ARD-2128在小鼠、大鼠、犬、猴和人五种属中的血浆稳定性。数据显示ARD-2128在所有五种属中都具有稳定的血浆稳定性。 ARD-2128 在五种属中的肝微粒体中代谢稳定性和血浆稳定性[1]
ARD-2128 在五种属中的肝微粒体中代谢稳定性和血浆稳定性[1]
 总结
总结- 虽然拥有诸多优点,但PROTAC药物开发仍然面临许多技术难点。成药性是其难点。同时,需要寻找更多可用的E3泛素连接酶及其结合物。此外,还需要考虑如何改善大规模生产方案,提高产率,从而降低成本。美迪西PROTAC药物研发服务平台不仅包含设计合成 PROTAC和进行PROTAC的体外活性研究,还能对PROTAC进行动物体内药效检测、药代动力学研究和安全性评价等,并汇总实验结果和材料进行 IND 申报,以助力客户加快PROTAC药物的研发进程。美迪西部分助力PROTAC项目案例——CG001419
2022年8月,睿跃生物(Cullgen)宣布用于治疗晚期实体瘤的TRK降解剂(CG001419)新药临床研究(IND)申请获批。CG001419是全球首创(First in class)的TRK (神经营养因子受体酪氨酸激酶)蛋白降解剂。CG001419作为全球首创的高选择性强效口服靶向蛋白降解剂,其适应症为用于治疗治疗NTRK基因融合、NTRK基因点突变和NTRK基因扩增或过表达晚期或转移性成人实体瘤。作为睿跃生物的合作伙伴,美迪西为CG001419的研发提供了符合中、美GLP规范的(包括药物代谢动力学研究和安全性评价在内的)综合性临床前研究服务,以合规、高效、高质的服务助力其成功获批。GT919
2023年5月,标新生物分子胶降解剂管线1类新药GT919胶囊获得FDA批准进入临床试验,用于恶性血液肿瘤的治疗。该管线此前已于2022年12月20日获得国家药品监督管理局(NMPA)批准开展临床试验,目前正在中国进行I期临床研究。
对于GT919的研发,美迪西凭借扎实的研发实力,高效完成了其从药物发现到临床申报,包括药物发现、药学研究、临床前研究等一站式临床前研究服务。GT929
2023年10月,标新生物第二个分子胶降解剂管线1类新药GT929胶囊获得FDA批准进入临床试验,用于治疗恶性血液肿瘤。该管线此前已于2023年7月获得NMPA批准开展临床试验。GT929是一款靶向IKZF1/3靶点的分子胶,在弥漫大b细胞淋巴瘤动物模型中显示了极佳的效果。
作为标新生物的战略合作伙伴,美迪西为GT929的研发提供了制剂研究、临床前研究(包括药效、药代、安评)以及撰写中英文申报资料等服务,为GT929快速实现中美双报双批提供了技术保障!
 推荐阅读:
推荐阅读:- 参考文献:[1]. Xin Han, et al. Strategies toward Discovery of Potent and Orally Bioavailable ProteolysisTargeting Chimera Degraders of Androgen Receptor for the Treatment of ProstateCancer. J Med Chem. 2021 Sep9;64(17):12831-12854.
[2]. AyeshaA Shafi, et al. Androgen receptors in hormone-dependent and castration-resistantprostate cancer. PharmacolTher. 2013 Dec;140(3):223-38.
[3]. Weiguo Xiang, et al. Discovery of ARD-2585 as an Exceptionally Potent and Orally Active PROTACDegrader of Androgen Receptor for the Treatment of Advanced Prostate Cancer. J Med Chem. 2021 Sep 23;64(18):13487-13509.
[4]Si-Min Qi, et al. PROTAC: An Effective Targeted Protein Degradation Strategy for Cancer Therapy. Front Pharmacol. 2021 May 7;12:692574.
[5] Galen Andrew Collins, et al. The Logic of the 26S Proteasome. Cell. 2017 May 18;169(5):792-806.
[6]Madhusoodanan Mottamal, et al. From Pure Antagonists to Pure Degraders of the Estrogen Receptor: Evolving Strategies for the Same Target. ACS Omega. 2021 Mar 30;6(14):9334-9343.
[7]Jared A M Bard,et al. Structure and Function of the 26S Proteasome. Annu Rev Biochem. 2018 Jun 20;87:697-724.[8]Xin Lin, et al. Targeting estrogen receptor α for degradation with PROTACs: A promising approach to overcome endocrine resistance. Eur J Med Chem. 2020 Nov 15;206:112689.











 查看更多服务案例
查看更多服务案例
























