



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




5月21日,中国国家药监局(NMPA)官网最新公示,礼来公司递交的替尔泊肽(Tirzepatide,商品名:穆达峰Mounjaro)注射液上市申请已获得批准,用于治疗成人2型糖尿病患者血糖控制的增强治疗。
此前5月16日,恒瑞医药宣布将旗下自研GLP-1产品组合的大中华区外全球权益授权给美国Hercules公司。除了获得授权费用,此次BD交易后,恒瑞还将成为美国Hercules公司股东之一[1]。
此次恒瑞自研组合包含三款GLP-1产品。
GLP-1R/GIPR双靶点激动剂,处于III期临床阶段,评估其在超重或肥胖受试者中持续48周的有效性和安全性。同靶点药物替尔泊肽(Tirzepatide,礼来)截止2023年11月,在美国完成2型糖尿病和肥胖的双适应症批准;5月21日NMPA公示,其成人2型糖尿病适应症已在华获批,长期体重管理适应症尚在审评中。
下一代肠促胰素产品,处于临床前开发阶段,可通过激活多靶点,保护胰岛的同时提高胰岛素分泌,控制血糖,有望实现更好的减重效果和治疗代谢功能障碍相关疾病。目前全球尚无同类产品上市。
新型口服小分子GLP-1受体激动剂,处于II期临床阶段,用于治疗2型糖尿病和肥胖。全球范围内尚无口服小分子GLP-1受体激动剂上市。
此次涉及的三款恒瑞GLP-1产品,均具有差异化创新之处。
对于即将加入或正在这场“竞速赛”中沉浮的GLP-1玩家,该如何应对趋向多元化的竞争态势?基于此次“国产”GLP-1的跃进,我们可就以下三点考量布局。
2024年5月15日,来自丹麦哥本哈根大学诺和诺德基金会基础代谢研究中心的研究人员在《自然》杂志上发表了一种创新的双功能分子:GLP-1–MK-801的重要预临床研究成果[2]。

GLP-1与减重:GLP-1受体激动剂不仅刺激胰岛素分泌治疗糖尿病,还能通过影响大脑中与奖赏回路相关的多巴胺信号通路来抑制食欲和调控饮食。
NMDA受体与减重:NMDA受体在神经突触可塑性中起关键作用,与肥胖有联系。早期针对NMDA受体的减重治疗因副作用(如体温异常升高和过度活跃)而受阻。
GLP-1–MK-801通过一种特殊的二硫键,将NMDA受体拮抗剂MK-801与GLP-1类似物连接。实验数据初步显示,其在减轻小鼠体重、减少体脂量和降低血浆胆固醇水平方面,比单独使用GLP-1或MK-801更有效。而在安全性方面,实验数据未显示出对小鼠的肝脏功能、心律、动脉血压和心脏重量产生不良影响,且未观察到体温过高或过度运动的副作用。
作为一种新型双功能分子,GLP-1–MK-801显示出在减重治疗领域的巨大潜力。该研究创新的药理学策略以及药物调节神经突触可塑性的发现着实为减重领域带来关键性的进展。
但由于实验中小鼠仅接受治疗两周,其长期有效性和安全性仍需进一步验证。此外,该药物在减重与代谢相关协同作用的具体机制,以及给药方案的优化,也是未来研究的重要方向。
2024年4月30日,俄罗斯科学家在《国际分子科学杂志》发表了近年来GLP-1受体激动剂心血管保护作用研究进展的系统梳理,提示了GLP-1受体激动剂在心血管保护方面的作用不仅仅是减重和降糖带来的间接好处[3]。

GLP-1类似物在2型糖尿病治疗中,不仅可以控制血糖、体重,更重要的是可以通过激活心血管组织的GLP-1受体,多途径、多环节直接保护心血管,包括抑制心肌细胞死亡,改善心肌能量代谢,减轻炎症和氧化应激等,由此可改善心梗、心衰等心血管疾病的预后,有望推动以GLP-1为基础的全新心血管疾病防治策略和药物的诞生。
今年5月8日,FDA正式批准了司美格鲁肽(商品名:Wegovy,诺和诺德)用于心血管疾病的治疗。拓宽适应症,或成GLP-1们的必争之地。
为了形成差异化优势,应充分借助CRO企业的力量,缩短开发周期、提高开发效率。
美迪西依托二十年积累形成的技术优势和研发平台优势,围绕GLP-1新药研发需求不断拓展产业链上下游领域,配备有分子克隆室及基于蛋白质晶体学的药物发现与筛选平台和GMP或非GMP制剂车间,建立了肥胖及糖尿病大/小鼠模型,形成全方位一体化的临床前CRO服务模式。
截至2024年4月,美迪西已成功助力8个GLP-1药物获批临床,其中:3个GLP-1药物NMPA/FDA同时获批,1个GLP-1药物获得美国FDA、中国NMPA、澳洲TGA三国批准,另外有多个GLP-1项目在研,在相关领域积累了丰富的经验。
目前大约80%的蛋白多肽药通过注射途径给药。为改善多肽类药物稳定性,延长多肽药物的体内半衰期,使其长效化,除了对多肽进行分子结构的改造,如采用氨基酸替代或环化、PEG修饰、融合长效化片段(与Fc融合、与人血清白蛋白融合)、缀合脂肪酸链等策略。还可通过制剂学手段改善多肽类药物的吸收并使其长效化,能够有效缩短药品研发周期、降低药品研发成本,也可能为药物使用开发新的适应证。
注射型多肽药物主要制剂类型为冻干粉。近年来,随着各种递药系统的发展,研究人员开发了多肽药物多种不同的制剂类型,呈现出多种给药途径。目前多肽药物制剂有注射用微球、植入剂、缓释脂质体、微乳、纳米粒、口服长效片剂/胶囊剂 、口服微粒、 微针贴剂 、经皮微粒给药系统等。
美迪西可提供GLP-1药物的原料药工艺开发和制剂研发服务。在确保研发质量的基础上,美迪西团队通过严谨的试验方案设计(DOE)、专业化的研发技术、标准化的项目管理、规范化的试验操作、高效的多方沟通,持续助力客户的GLP-1药物研发。
美迪西多年来深耕动物领域,为药物研发提供合适的动物模型, 可提供多种用于评估GLP-1药物的糖尿病模型及肥胖模型,在AAALAC认证的环境下完成模型动物的建模和饲养,并以GLP-like的高标准完成相关药效学评价试验。
❖ 多种实验动物
啮齿类:小鼠/大鼠、兔子
非啮齿类:比格犬、小型猪、非人灵长类动物
❖ 美迪西案例:活性GLP-1检测
这项研究是在一小部分选定的血糖正常健康受试者中进行的。本次研究由中南大学湘雅药学院、南京医科大学第一附属医院、盛世泰科生物医药技术(苏州)有限公司、北京诺和德美医药技术有限公司联合进行,其中活性GLP-1检测通过美迪西进行。
实验结果表明,盛格列汀(Cetagliptin)在剂量≥50mg时每天给药一次表现出最小的积累,在24小时给药间隔内抑制血浆DPP-4活性达到80%以上,且增加活性GLP-1水平而不产生低血糖。且盛格列汀(Cetagliptin)具有良好的临床耐受性和安全性。
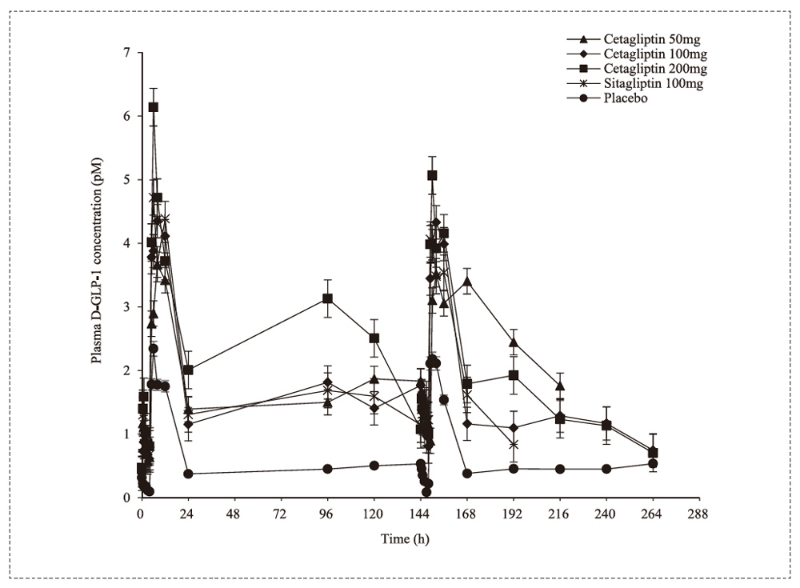
活性D-GLP-1检测
美迪西在GLP-1相关药物的体内分析中提供了多种高质量的测试方法,通过分析动物体内采集的血浆/血清样本,为客户提供可靠优质的PK数据。
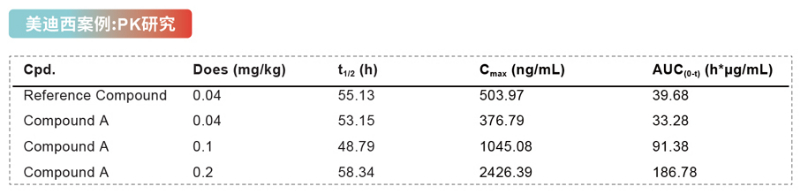
Compound A 的药代动力学参数
实验结果显示,血浆药物暴露量(Cmax 和AUC(0-t))的增加与给药剂量的增加比例基本一致。单次皮下给予0.04mg/kg 的对照品注射液和0.04 mg/kg 的Compound A注射液后,相对生物利用度为83.17%。
❖ MDR-001
2023年4月20日,据CDE官网,德睿智药科技MDR-001片获批临床,拟开展治疗2型糖尿病和肥胖或超重患者的体重管理的研究。MDR-001是德睿智药通过其AI驱动药物发现平台Molecule Pro开发的一款非竞争性口服GLP-1R小分子激动剂,已于2022年12月获FDA批准开展临床。临床前研究显示,MDR-001具有优异的药效和选择性,良好的ADME和口服生物利用度以及更优的药代动力学特征,具备best-in-class潜力。
作为德睿智药的合作伙伴,美迪西为MDR-001提供了原料药工艺开发和制剂研发服务。在确保研发质量的基础上,美迪西通过严谨的试验方案设计、专业化的研发技术、标准化的项目管理、规范化的试验操作、高效的多方沟通,加速了研发进程,对这一重量级GLP-1R激动剂获批临床做出了自己的贡献。
❖ 更多案例推荐阅读:美迪西一站式“GLP-1”新药研发服务能力介绍
参考资料:
[1]恒瑞医药官方公开资料
[2]https://www.nature.com/articles/s41586-024-07419-8
[3]https://pubmed.ncbi.nlm.nih.gov/38732142/
 相关新闻
相关新闻