



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





2023年12月8日,美国FDA批准了两款具有里程碑意义的疗法——Casgevy和Lyfgenia。
这是首批用于治疗12岁及以上镰刀型细胞贫血症 (SCD)患者的基因疗法,且Casgevy是FDA批准的首款基于新型基因编辑技术的基因疗法,今年11月已在英国获批。
Casgevy(exagamglogene autotemcel,exa-cel),由CRISPR与Vertex共同研发,利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。
HbF是人类胎儿期自然存在,携带氧气的血红蛋白形式,但在出生后其基因便会迅速被沉默,并随着成长转换为成人形式的血红蛋白。对于SCD患者而言,HbF的存在能够抑制异常镰刀型红细胞的产生,提升携氧能力,大幅改善患者的溶血性贫血和血管阻塞现象。
通过Casgevy治疗,可以提高HbF水平,有可能缓解输血依赖性β地中海贫血患者的输血需求,并减少镰刀型细胞贫血病患者的疼痛和使人衰弱的血管闭塞性危象。
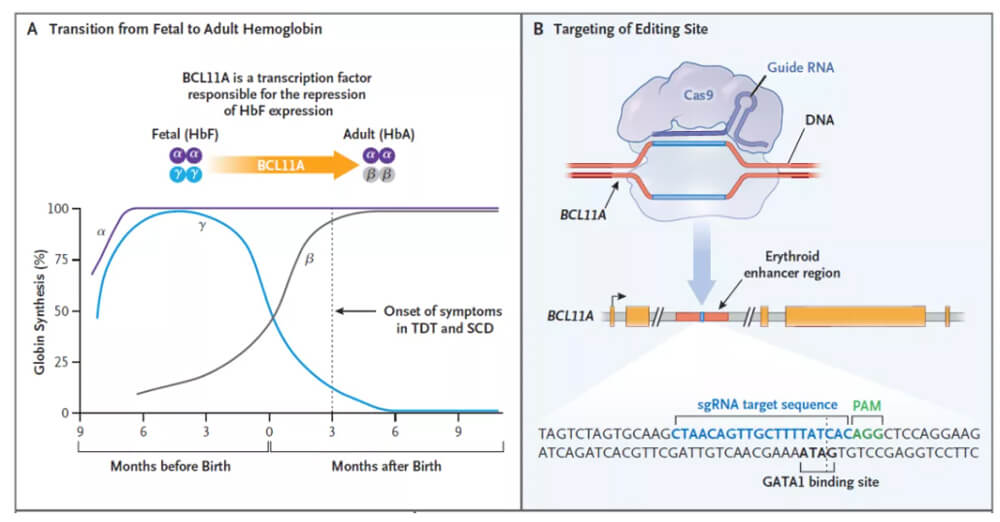
Casgevy的作用机制
A:BCL11A是下调胎儿血红蛋白表达的转录因子
B:对BCL11A进行基因编辑,上调血红蛋白表达
Lyfgenia(lovotibeglogene autotemcel,lovo-cel),蓝鸟生物自主研发,基于慢病毒载体技术,利用基因编辑后的慢病毒在体外感染患者的造血干细胞,将血红蛋白A的一种变异型——HbAT87Q基因,引入患者的造血干细胞中。
HbAT87Q型与野生型HbA具有相似的氧结合能力,限制红细胞镰状化,并有可能减少血管闭塞事件。相比于SCD患者体内携带的突变体血红蛋白,HbAT87Q拥有着非常好的稳定性,携带它的红细胞更不容易出现溶血或血管内聚集等现象。
在临床研究中,以上两种疗法在SCD人群中都展现出了良好的疗效,基因编辑与慢病毒改造造血干细胞技术并驾齐驱,分别是两大领域的里程碑式进展。
SCD由β-珠蛋白(构成血红蛋白的一种蛋白质)的特定基因突变引起,这种突变降低了血红蛋白的溶解性并增加了红细胞的不稳定性,因此,患者体内存在着大量镰刀状的异形红细胞。
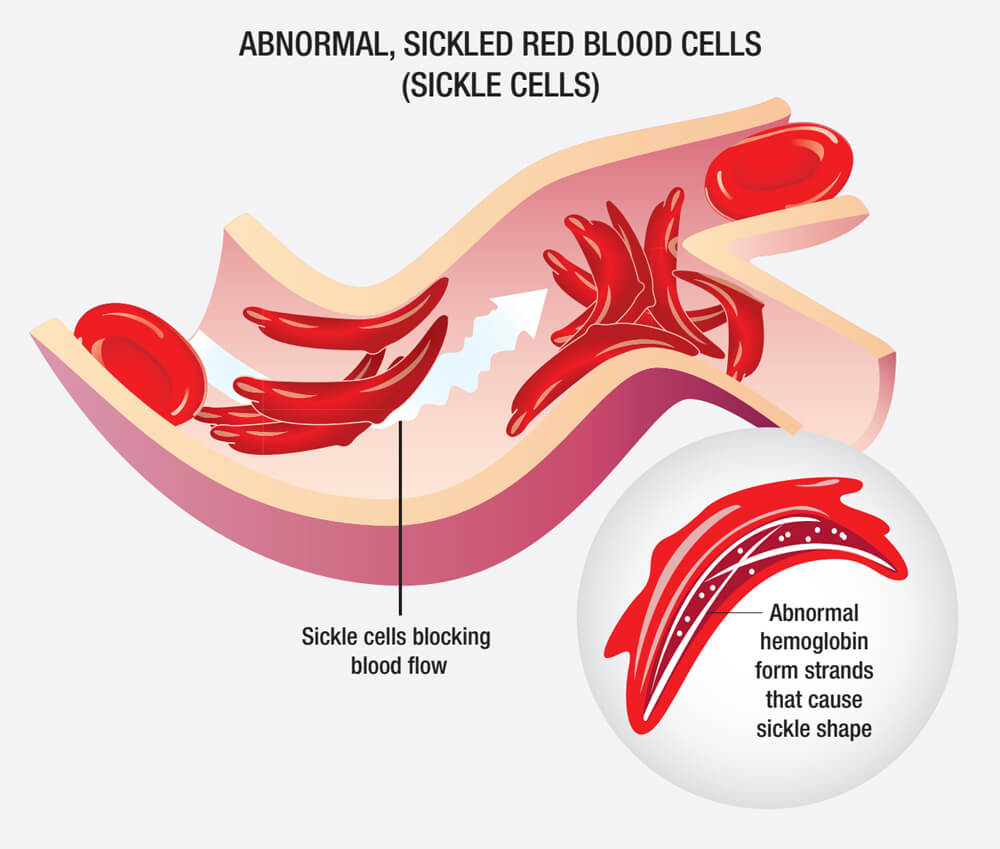
镰刀状异形红细胞(图源:NIH)
SCD患者既存在异常血红蛋白诱发的持续性、溶血性贫血,同时也会因异形红细胞聚集导致血管堵塞。此外,大部分患者会因疾病的反复发作而逐渐失去脾功能,出现免疫力低下、全身多器官并发症,严重影响生活质量,甚至猝死。
Casgevy的获批就像打开了潘多拉魔盒,想要使用这项只有10年研究历史的超强工具,就得勇于接受安全性的挑战,包括可能存在的脱靶效应、效率问题、免疫排斥和片段丢失等技术难点。
随着更多基因疗法的获批,生物分析方面的挑战接踵而至,特别是跟免疫原性评估相关的问题。当治疗剂通过免疫介导的清除、中和或细胞免疫反应引起阻断治疗产品功效的免疫反应时,可能导致多种免疫相关毒性。
免疫原性数据是监管部门批准疗法的必备条件,以评估疗法短期及长期的安全性和有效性。由于基因治疗本身的复杂性,在对其进行免疫原性测试时我们就需要考虑更多因素:给药途径/方案,患者/适应症,载体生物学特征,表达产物特性,导入基因特性等。

基因疗法的构成
针对基因治疗产品的免疫原性可能涉及一下3点:
❖ 病毒载体直接激活的固有免疫反应,产生急性毒性。
❖ 预先存在的抗病毒载体或产物蛋白的中和性抗体。
基因疗法通常是多组分药物,而不仅仅由单一分子组成,也不单纯由一个融合分子或多域分子组成。这些药物成分包括传递载体、经传递的核酸以及由核酸编码的治疗蛋白,每个成分都会引发不同的免疫反应。这也意味着,安全和疗效问题可能涉及到基因药物结构的多种元素。
❖ 针对病毒载体和产物蛋白引起的适应性体液免疫和适应性细胞免疫反应。
❖ 预先存在的抗病毒载体或产物蛋白的中和性抗体。
基因疗法还能引发多种体液和细胞反应,这意味着生物分析评估不仅仅是关注抗体的产生。与此同时,先天性免疫和适应性免疫之间存在着多种桥梁:比如活化的巨噬细胞一旦攻击了吞噬细胞入侵者,就可以充当抗原代表细胞(APC)。
在此基础上,遵守对使用基因治疗产品的患者进行长期随访(LTFU)的监管标准非常重要。Casgevy的研发公司Vertex建议,在试验参与者接受治疗后对其进行15年跟踪随访,以观察长期影响。
2021年12月3日,CDE颁布了《基因治疗产品长期随访临床研究技术指导原则(试行)》;而美国FDA和欧洲药品管理局(EMA)都在各自的监管协议中设立了与长期随访相关的规定。这类评估有助于监测患者的延迟不良事件(如延迟毒性),确保患者的长期安全,并指导确定最佳的治疗方式。
Editas Medicine的EDIT-301(renizgamglogene autogedtemcel,reni-cel),也是一款基于CRISPR基因编辑技术的体外基因编辑药物,目前正在进行I/II期临床试验。近日在美国血液学会(ASH)年会上,Editas Medicine公布了共17位患者的最新数据。
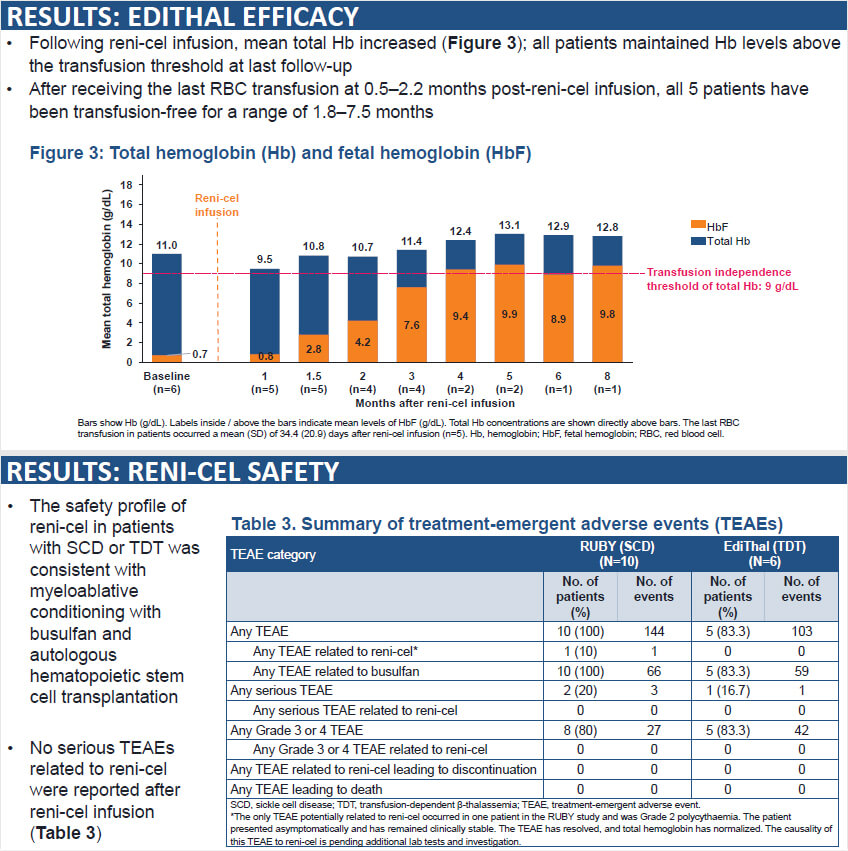
Editas Medicine 官网海报
❖ RUBY试验:用于治疗严重SCD(n=11),所有患者均未发生血管闭塞事件(VOE)。
❖ EdiTHAL试验:用于治疗输血依赖性β-地中海贫血(n=6),所有患者的总血红蛋白均早期稳步升高,且高于输血非依赖性阈值9 g/dL(n=6)。
❖ 药物安全性:迄今为止,两项试验均耐受良好,并在所有患者中陆续显示出与白消安清髓性预处理和自体造血干细胞移植一致的安全性特征(n=17)。未报告与reni-cel治疗相关的严重不良事件(SAE)。
Intellia Therapeutics的NTLA-2001,是全球进展最快的体内CRISPR基因编辑药物,正在进行临床III期试验,用于治疗转甲状腺素蛋白淀粉样变性心肌病和转甲状腺素蛋白家族性淀粉样多发性神经病,通过降低血清中TTR的浓度来治疗ATTR淀粉样变性。
NTLA-2001应用LNP肝脏递送系统,携带靶向人TTR基因的sgRNA和经过优化的化脓性链球菌Cas9蛋白的mRNA序列。

NTLA-2001的作用机制(来源:新英格兰医学杂志)
其他还包括:
❖ Beam Therapeutics的BEAM-101,依托碱基编辑技术,用于治疗SCD和β-地中海贫血。
单碱基编辑(single base editing)作为一种最新的基因编辑工具,能够在不导入双链断裂的情况下直接进行碱基的替换,具有编辑效率高和特异性强的特性,为精确基因修饰提供了一种更简单、更有效的方法。
❖ 应用先导编辑技术的Prime Medicine,目前管线均处于临床前阶段。
Prime editing(PE)是一种精准的基因编辑技术,可以在细胞和动物中以可编程方式安装替换、插入和缺失,而无需双链DNA断裂 (double-strand DNA breaks, DSBs),具有多功能性、特异性和精确性的优势。
在毒理学研究中,应对基因治疗产品进行全面的安全性分析评估,必要时还应评估导入基因的表达产物的安全性。基因治疗产品应能在相关动物种属中有效导入/暴露。
基于国际认证的AAALAC质量标准和依从国际、国内GLP规范的药物安全性评价质量管理体系,自2008年以来,美迪西持续对标国际水准,高质量完成GLP的安全性评价服务,建立了长期的品牌效应。我们可以开展涵盖多毒性终点的系统评价服务,并拥有国际认可的病理学研究支持我们的安全性评价研究。
美迪西在药物安全性评价方面有专业的团队和实战经验,可提供高质量的数据和快速的周转期以支持各项药物安全评价研究。毒理学研究可按照non-GLP或GLP标准执行。我们的研究平台已被评为上海研发公共服务平台。截至2022年底,美迪西已完成12个IND申报全流程项目(包括原料药、制剂、PD、PK和安全性评估)。
如您对本期话题有进一步想要了解的内容,或您希望美迪西Marketing讨论更多行业资讯,欢迎点击:文章最下方「发消息」给我们留言互动。期待您的"美"思妙想~

marketing@medicilon.com.cn
微信或邮件联系我们
1.https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease
2. Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.
3. 官网公开资料
 相关新闻
相关新闻