



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




HILIC是一种色谱分离技术-亲水作用色谱(hydrophilic-interaction chromatography)的简称,也称为非水反相色谱或者反反相色谱,由Alpert教授于1990年提出,并将HILIC模式和正相模式(NPLC)进行了区分[1]。
HILIC模式和正相有着类似的洗脱方式,由于使用了反相溶剂系统(水和有机相),从而具备正相所没有的优势,例如系统中可以含水,对于化合物的稀释剂选择更多,重现性更好,可以连接MS进行联用等等(HILIC模式含有高比例有机相,相比于水相更多的反相,更容易去溶剂化,增加离子化效率,提高灵敏度,如图1所示)。HILIC模式可以避免使用离子对试剂,对于大极性化合物的制备很有益。HILIC模式广泛应用于大极性化合物的分离,例如药物、糖类、蛋白、多肽、氨基酸等等。
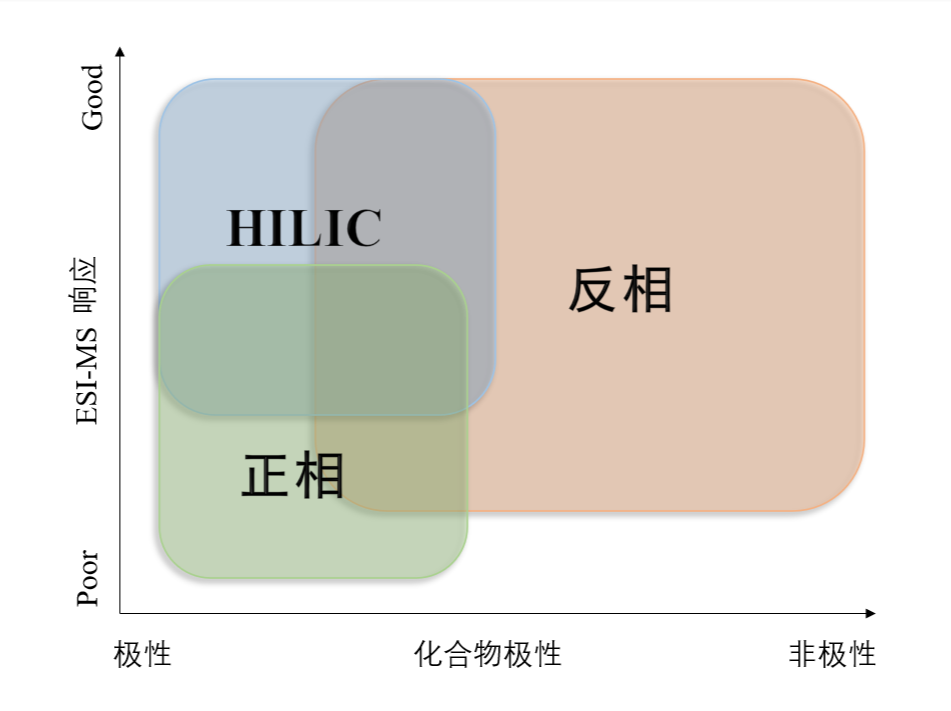
图1:不同模式对化合物的应用范围
HILIC的保留机制是液液分配、吸附作用、离子相互作用和亲水性保留作用等多种模式作用的综合体现,化合物的保留一般受其化学性质和结构、固定相和流动相作用以及流动相种类(有机溶剂种类以及流动相pH)影响。
HILIC模式的色谱柱的固定相采用未衍生化硅胶或杂化颗粒、酰胺基、氨基、二醇、两性离子、环糊精类、聚琥珀酰亚胺键合物质等极性填料,所以化合物的保留强度和其极性成正比,和流动相极性成反比。极性溶剂的存在可以使固定相表面形成一层极性层,如图2所示,因此对于利用液液分配作用进行保留的化合物,流动相中极性溶剂是必不可少的,一般至少包含3%极性溶剂 [2]。
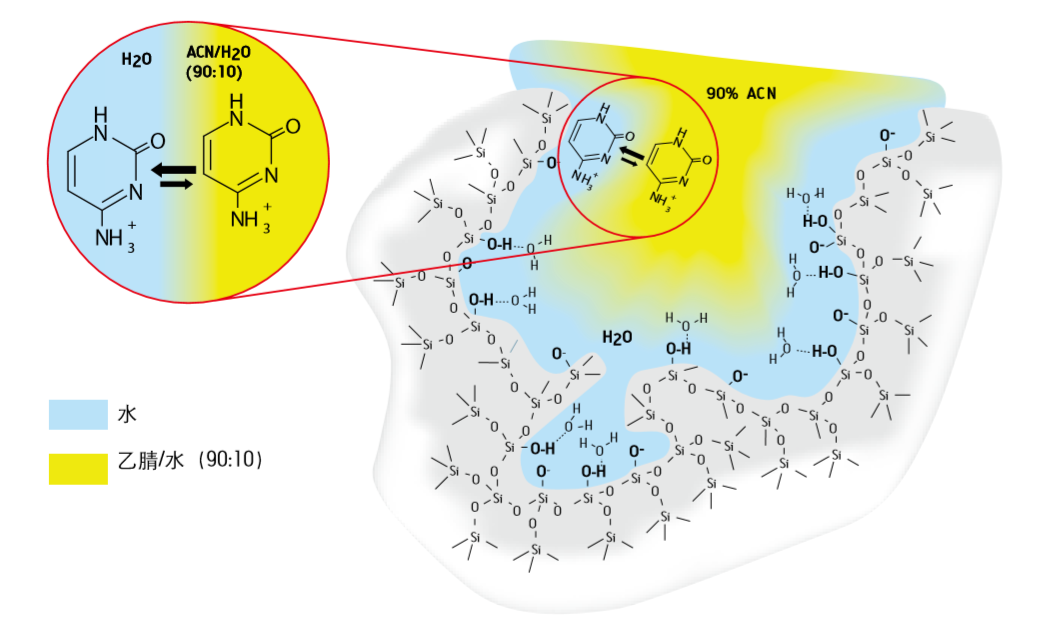
图2:胞嘧啶在流动相和固定相表面吸附水层液液分配
在流动相中添加缓冲盐和添加剂也是常用手段,有助于改善峰型和保留,缓冲盐在面对固定相表面极性层和非极性溶剂时,更加倾向于溶解于极性层,随着盐浓度增加从而增加其亲水性, [3]。
其中,甲酸铵和乙酸铵是最常用的缓冲盐,这得益于它们在有机溶剂中良好的溶解性以及MS兼容性。需注意的是,随着盐浓度的提高,化合物和固定相的离子作用会受到抑制,主要作用为液液分配 [4~7],这就导致碱性化合物的保留减弱,是因为大量的阴离子和碱性化合物配对形成中性离子对更容易溶于有机相;相反,酸性化合物保留则会增加,是由于带负电的硅醇离子排斥作用减弱,从而与固定相作用增强。
一些固定相填料表面上具有带电硅醇,具有一定酸性,在pH5~9时,硅醇基团就处于电离状态,对于带电状态的化合物离子交换作用将扮演重要角色 [3]。需注意的是,由于HILIC模式下具有高比例有机相,高或低pH的缓冲盐溶于其中时,其真实pH值会由缓冲盐pH值向中性靠近1~1. [8],使化合物处于电离状态的pH值,更利于化合物的保留。
一般酸性化合物在高pH(常用氨水、碳酸氢铵等)条件下保留强于低pH条件,碱性化合物在低pH(常用乙酸、甲酸、乙酸铵、甲酸铵等)条件下保留较好。
HILIC模式洗脱溶剂强度为:四氢呋喃 < 丙酮 < 乙腈 < 异丙醇 < 乙醇 < 甲醇 < 水(由弱至强),如图3所示,四氢呋喃、丙酮和乙腈洗脱能力最弱,可作为主要溶剂使用,由于丙酮的截止波长330nm过高,在UV检测器使用受限(可用于CAD、ELSD、MS等),而乙腈是非质子溶剂,能够增加化合物和固定相表面极性层的氢键作用,从而增加保留,因此作为最常用流动相之一,相当于反相中的水相,水的洗脱能力最强,常作为洗脱溶剂使用,可根据化合物保留情况选择合适的洗脱溶剂。
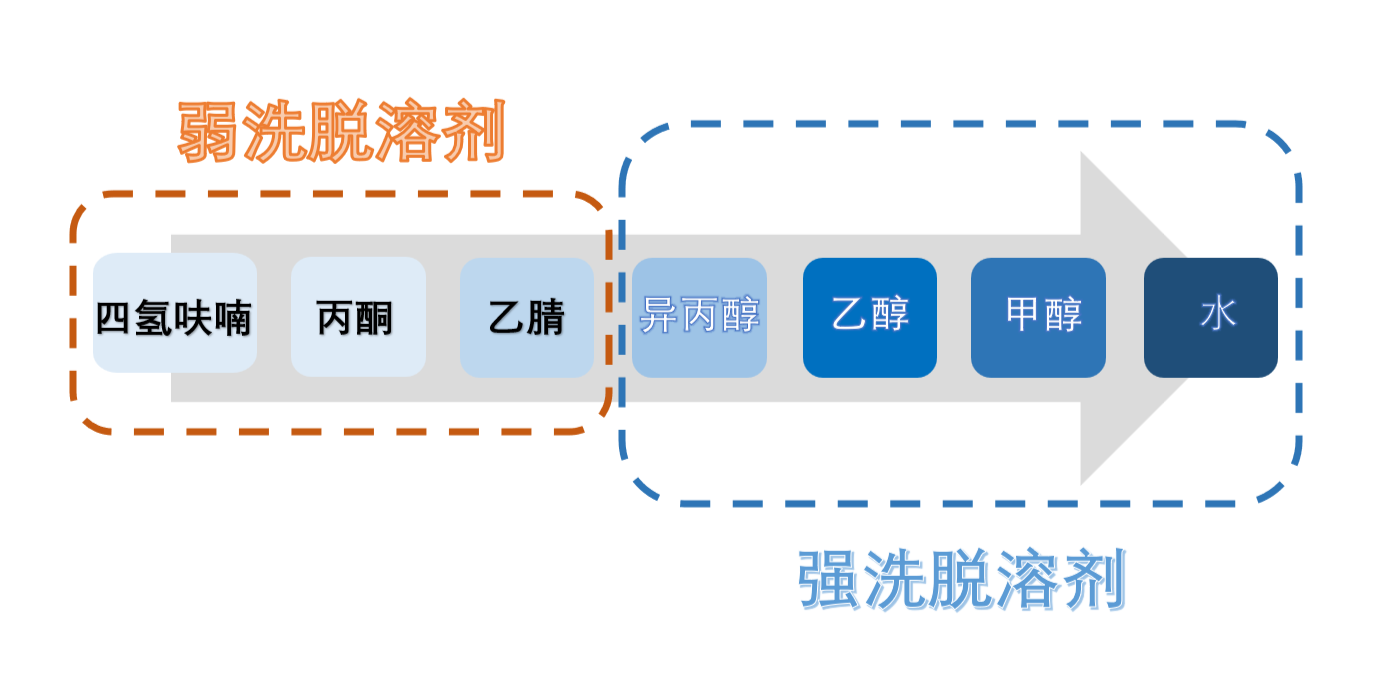
图3:HILIC模式洗脱溶剂强弱顺序
一般建议选择流动相起始比例溶解样品。由于HILIC模式乙腈的比例较高,很多大极性化合物难以溶解,为了保证化合物溶解,通常会将大极性溶剂——如水、甲醇等应用于稀释剂。在这种情况下和常规反相分离类似,HILIC模式使用强洗脱稀释剂时也会导致溶剂效应问题。而二甲基亚砜(DMSO)作为稀释剂,具有一定保留,并且DMSO在低波长下有较强的吸收,可能会影响目标化合物出峰,一般配合乙腈、甲醇使用,DMSO比例一般不超过25%。
常规可以考虑使用75%的乙腈和25%的甲醇混合液作为稀释剂,也可以加一些添加剂助溶,如甲酸等。需注意的是,样品的含水量如果过大,也会影响化合物出峰情况。
由于大极性化合物的保留极易受大极性洗脱试剂的影响,有时洗针液中的残留清洗溶剂会对化合物出峰产生影响,或者方法难以重现,一般建议采用流动相起始比例洗针。
为保证在分析过程中离子强度的稳定,可以在水相和有机相均加入同样浓度的添加剂,也可以考虑预混,需注意的是,在流动相配制过程中,混合后常常会产生温度变化,使用前需放置至室温。
色谱柱使用一段时间后,样品可能会残留在柱头堵塞柱筛板,这时可以考虑采用高浓度缓冲盐低流速进行反冲。以默克色谱柱SeQuant® ZIC-HILIC为例,首先采用30倍柱体积的超纯水进行冲洗,再用30倍柱体积的缓冲盐(可以用500mM乙酸铵溶液)进行冲洗,最后再用30倍柱体积的超纯水进行冲洗,不同填料处理可能不同。
对于未知化合物方法开发,可采用如图4所示的一般思路进行。需注意的是由于HILIC模式化合物保留方式特殊,固定相的极性水层来源于流动相,梯度不能变化过快,柱平衡需要留一定时间。

图4:HILIC模式未知化合物方法开发一般思路
对于已知化合物,则可以根据化合物性质进行选择,首先判断酸碱性,可以用ACD进行模拟,从而进行色谱柱的选择。

表1 色谱柱填料及应用范围
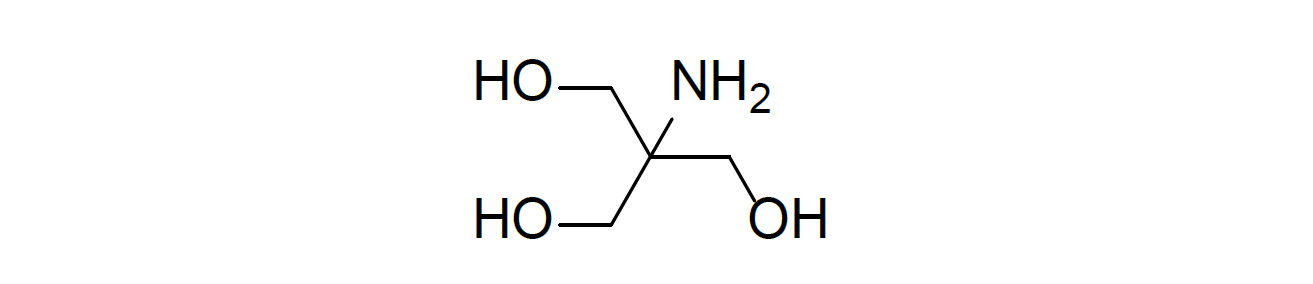
氨丁三醇在常规反相体系下没有保留,并且没有紫外吸收,遂采用HILIC模式,选择CAD检测器进行方法开发。氨丁三醇峰型良好,对称因子1.2(如图5所示),线性相关系数r 可做到1.000,回收率在97%~104%之间。
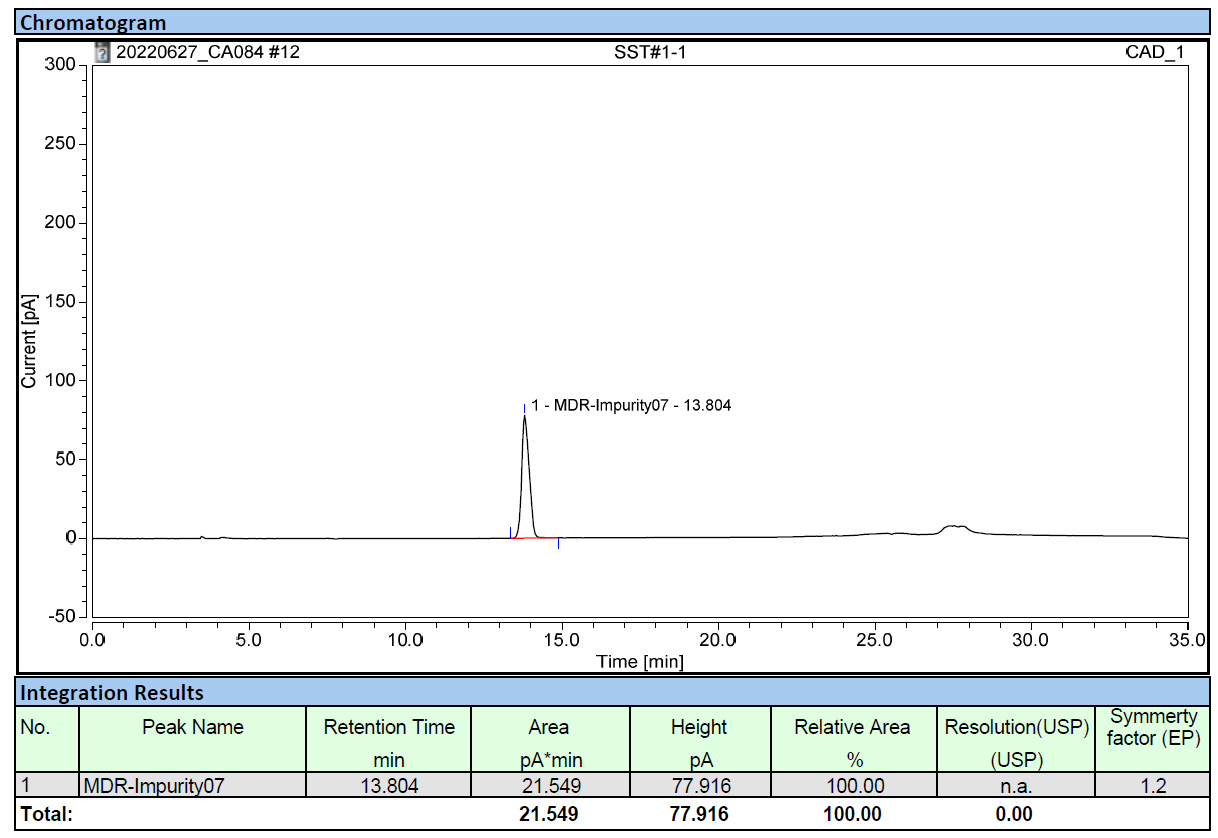
图5:氨丁三醇典型图谱
氨基酸大多是小分子两性化合物,在常规反相分离模式下保留很弱,通常采用衍生法进行检测,比如说赖氨酸,其 pKa 和 logD 见下图:
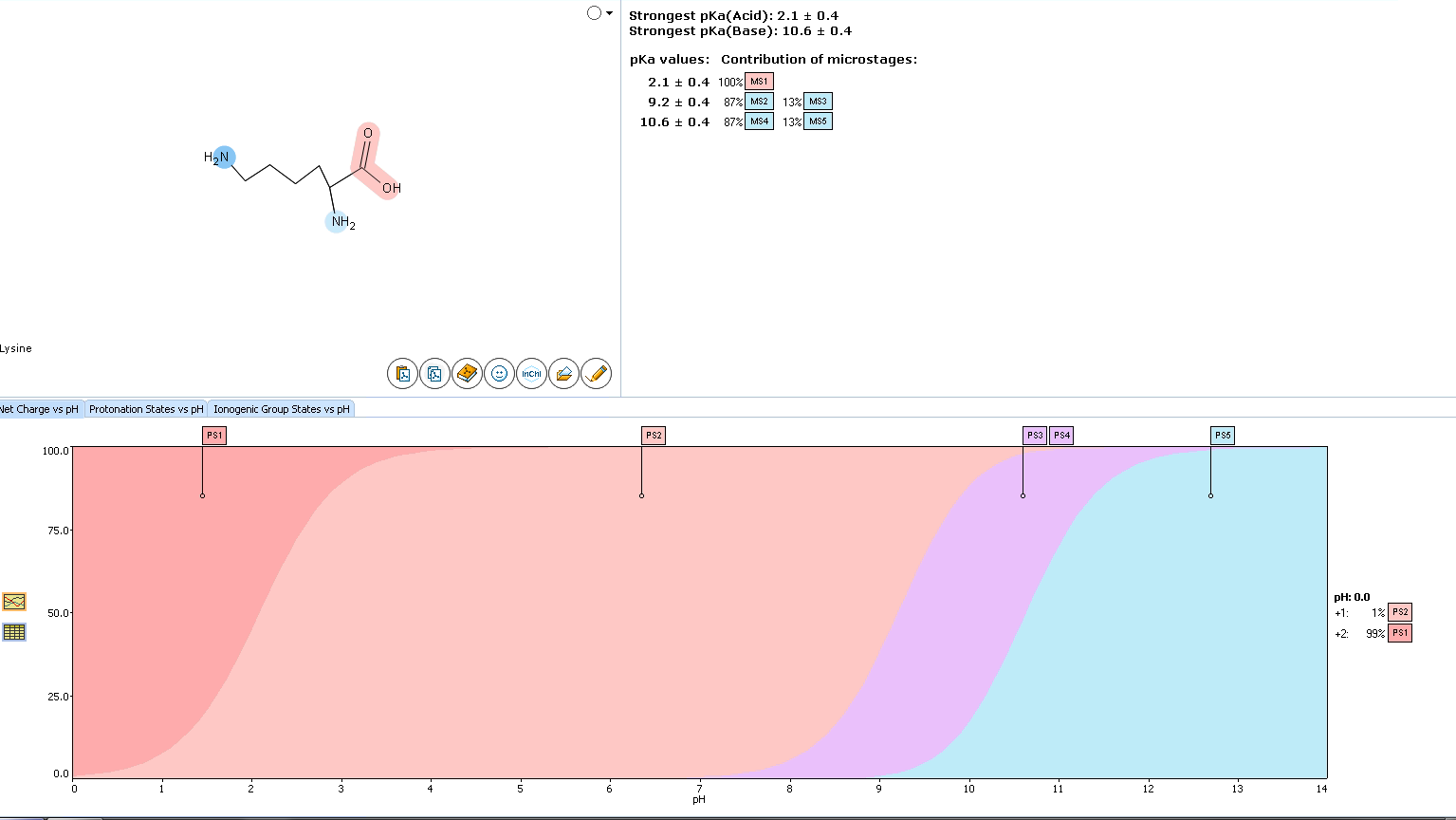
图6:赖氨酸 pKa
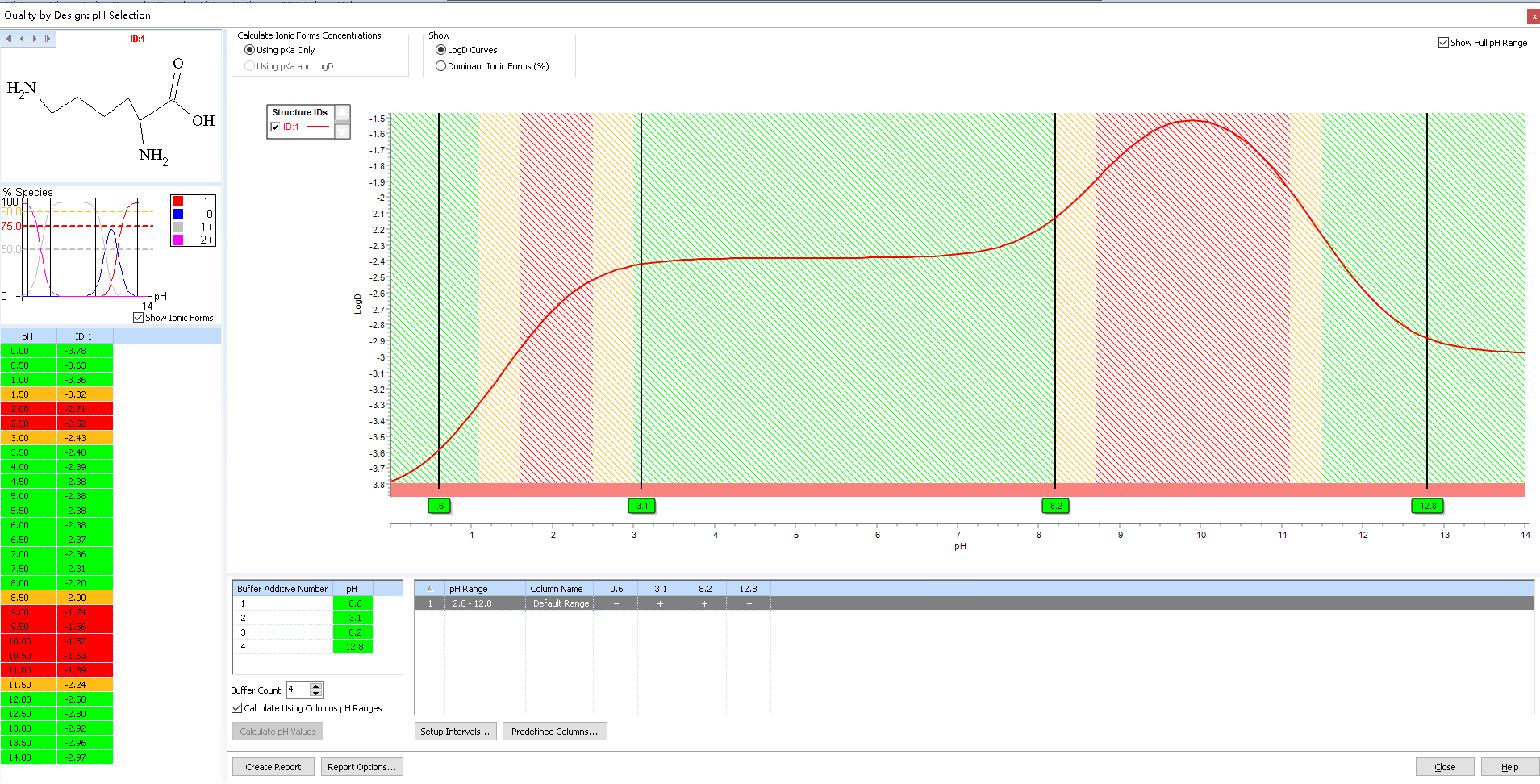
图7:赖氨酸 logD
赖氨酸的 logD 在所有条件下都是负值,常规反相体系无法产生保留行为,我们采用HILIC模式解决了赖氨酸的分析检测,得到了良好的保留(8min)和峰型(拖尾因子1.6),大大降低分析成本,便于方法转移和检测(如图8所示)。
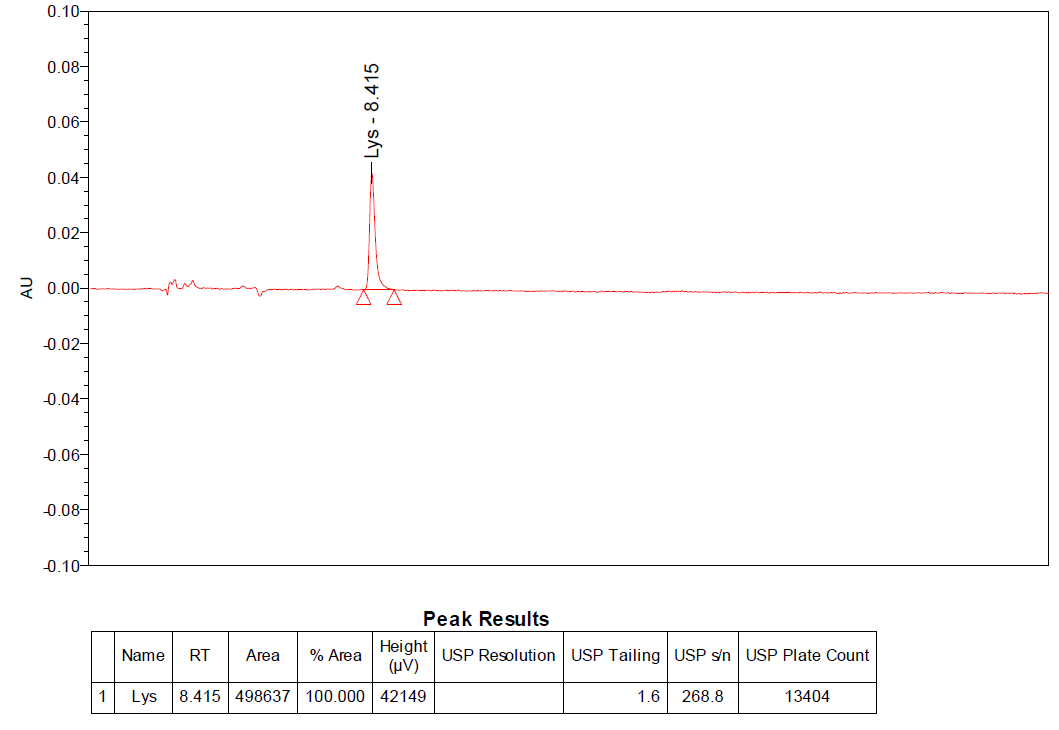
图8:赖氨酸典型图谱
对于没有保留、没有紫外吸收、不能碰水、极性和主成分接近的杂质,该如何分析呢?美迪西给出的答案是HILIC-MS模式。如葡甲胺的发补杂质中有一个席夫碱,该化合物极性大、没有紫外吸收、见水易分解,该杂质和葡甲胺极性接近,常规方法难以分离。
采用HILIC-MS模式进行方法开发,最终葡甲胺和该席夫碱杂质分离度在2.8以上,线性相关系数r为1.000,200ppm的LOD信噪比最小为25,回收率在94%~103%之间,且方法耐用性良好,各参数微小变化下,均可达到1.5以上基线分离,回收率在98%~102%之间。
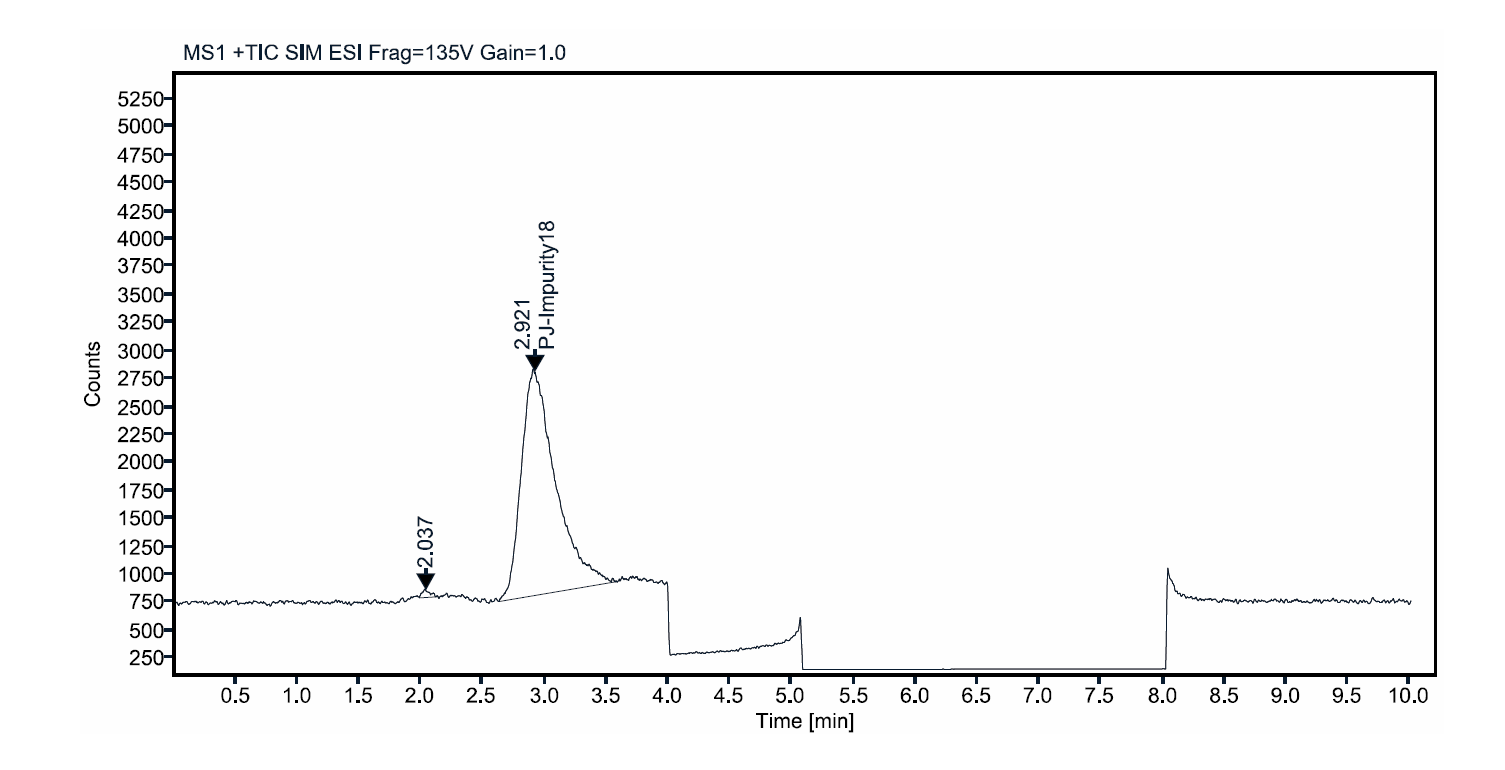
图9:分离度溶液典型图谱
美迪西已建立完善的分析测试中心,可以采用丰富的设备和多种先进的技术(高分辨、LCMSMS、GCMSMS、CAD、NMR、离子色谱、双三元等等)满足客户的各项分析需求!
(撰稿:李墨;编审:杜建,毕增)
参考资料:
[1] Alpert, A. J., J. Chromatogr. 1990, 499, 177-196.
[2] Waters亲水作用色谱, Eric S. Grumbach 和 Kenneth J. Fountain
[3] Jandera, P., J. Sep. Sci. 2008, 31, 1421–1437.
[4] Strege, M. A., Anal. Chem. 1998, 70, 2439-2445.
[5] McCalley, D. V., J. Chromatogr. A 2007, 1171, 46-55.
[6] Naidong, W., J. Chromatogr. B 2003, 796, 209-224.
[7] Liu, M., Ostovic, J., Chen, E. X., Cauchon, N., J. Chromatogr. A 2009, 1216, 2362-2370.
[8] Fountain, K. J., Xu, J., Diehl, D. M., Morrison, D., J. Sep. Sci. 2010, 33, 740-751.
美研|CMC系列回顾
❖ CMC系列(一)|浅谈药物研发中原料药工艺研究的重要性
❖ CMC系列(二)|药学研究之世界银屑病日
❖ CMC系列(三)|高端吸入药物的市场格局和研究现状
❖ CMC系列(四)|浅谈手性药物的研究策略
❖ CMC系列(五)|药物晶型控制策略
❖ CMC系列(六)|含氮类化合物-可挥发碱性有机胺的气相分析
❖ CMC系列(七)|新药研究中的固态开发挑战及应对策略
❖ CMC系列(八)|浅析ICH指导原则Q3C及未收录残留溶剂限度制定方法
❖ CMC系列(九)|定量核磁应用及其方法验证/定量核磁那些事儿
❖ CMC系列(十)|药物杂质研究策略之基因毒性杂质
❖ CMC系列(十一)|手性化合物的拆分策略与经验分享
❖ CMC系列(十二)|单晶结构解析在药物开发中的应用和单晶培养哪些事儿
❖ CMC系列(十三)|X射线粉末衍射法在药物晶型定性分析中的应用
❖ CMC系列(十四)|离子色谱的使用原理及其在药物研发中的应用
❖ CMC系列(十五)|杂质制备及结构确证案例分享