



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





ICH指导原则Q3C旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,建议使用低毒的溶剂,提出一些残留溶剂毒理学上的可接受水平。
残留溶剂定义为在原料药或辅料的生产中以及制剂制备过程中使用或产生的有机挥发性化合物,由于残留溶剂没有治疗益处,故应尽可能除去以符合相关质量要求。

图1 ICH Q3C(R8) 杂质:残留溶剂的指导原则
ICH指导原则Q3C适用于所有剂型和给药途径,其中药物在短期使用或局部使用时,还允许存在更高的残留溶剂水平,需要注意的是该指导原则不适用于临床研究开发阶段所使用新原料药、辅料和制剂,也不适用于已上市的制剂。
残留溶剂分为I类溶剂(已知的人体致癌物,强疑似人体致癌物,以及环境危害物,应避免使用)、II类溶剂(非遗传毒性动物致癌物质,或可能导致其他不可逆毒性如神经毒性或致畸性溶剂,可能有其他严重但可逆的毒性的溶剂,应限制使用)、III类溶剂(对人体低潜在毒性的溶剂,遗传毒性呈阴性,无须制定基于健康的暴露限度,是低潜在毒性溶剂)以及没有足够毒理学数据的溶剂,在做残留溶剂检测时,需要计算对照品称样量等,可以根据下列表格进行计算,下列表格为最新残留溶剂限度的汇总。

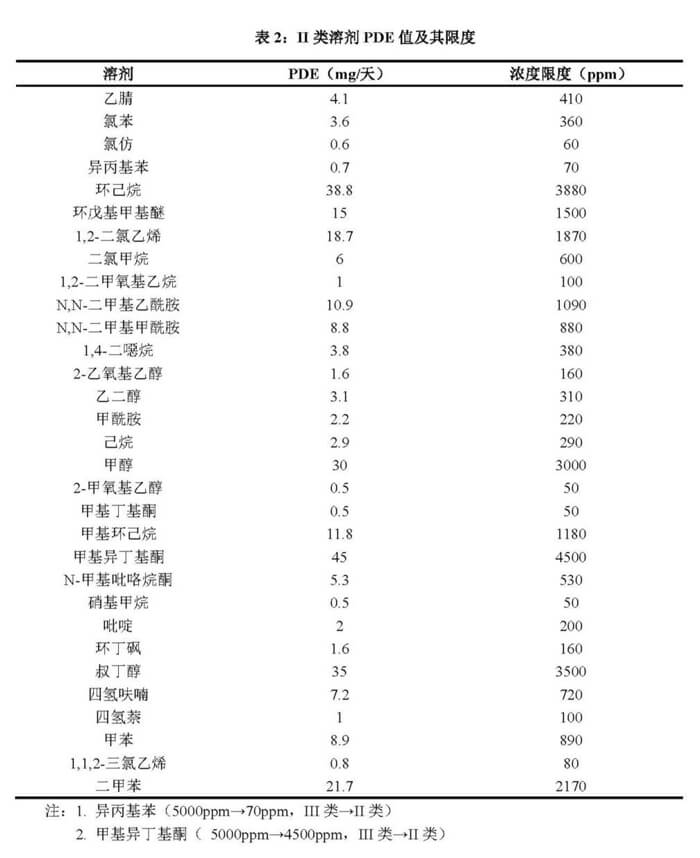

目前实行的是ICH Q3C(R8)版本,在之前版本进行了以下更新:
1. 乙二醇的PDE由3.1mg/day改为6.2mg/day,因此限度由310ppm改为620ppm。
2. 将叔丁醇(TBA)新增为二类溶剂,PDE为35mg/天, 限度为3500ppm。
3. 将CPME (环戊基甲醚)新增为二类溶剂,PDE为15 mg/天,限度为1500ppm。
4. 将2-MTHF(2甲基四氢呋喃)新增为3类溶剂,PDE为50mg/天。
除了以上三类溶剂外,还存在一些没有足够毒理学数据的溶剂,故没有PDE值,例如:1.1-二乙氧基丙烷、甲基异丙基酮、1.1-二甲氧基甲烷、甲基四氢呋喃、2.2-二甲氧基丙烷、石油醚、异辛烷、三氯乙酸、异丙醚、三氟乙酸等,这些残留溶剂的限度需要利用科学文献和毒理学数据来制定。
每日允许暴露量(PDE)定义为药学上可接受的残留溶剂摄入量,是由大多数相关动物研究中的未观察到作用水平(NOEL)或观察到作用的最低水平(LOEL)得出的,有了这个数据即可进行残留溶剂的限度计算。
PDE的计算公式为:

由公式可知,NOEL是计算得到PDE的关键,通过一些毒理研究数据可以得到相关结果,所以残留溶剂的控制策略首选NOEL的相关数据,根据ICH的相关内容,也可以使用LOEL来计算PDE,但是要根据作用的严重程度在计算时选择合适的F5。
有时查询相关数据还会查到NOAEL(No Observed Adverse Effect Level)-未观察到有害作用水平,Q3C限度制定方法的参考文献WHO环境健康指南170中TDI(Tolerable Daily Intake)-每日允许摄入量是使用该数值计算得到,并且在ICH Q3D指导原则计算元素杂质的PDE时也明确指出可以使用该数值进行计算,关于他们的区别简单来说,NOEL相当于未检出,LOEL相当于检出限以下的最大量,NOAEL相当于定量限以下的最大量,但是NOEL和NOAEL之间的界限较为模糊,在进行适当的评估后也可以使用该数值进行PDE的计算,但是,采用不同数据计算PDE时应选择不同的F5进行校正。
有些老师会选用LD50进行计算,利用NOEL=LD50×50/2000(源自欧盟原料药委员会发布的《原料药工厂中清洁验证指南》,2000为经验常数)进行计算得到PDE,其实用此公式应用存在一定局限性,PDE针对的是起作用,可以认为是一种有效性,而LD50是一种毒性,属于安全性范畴,二者没有必然联系。
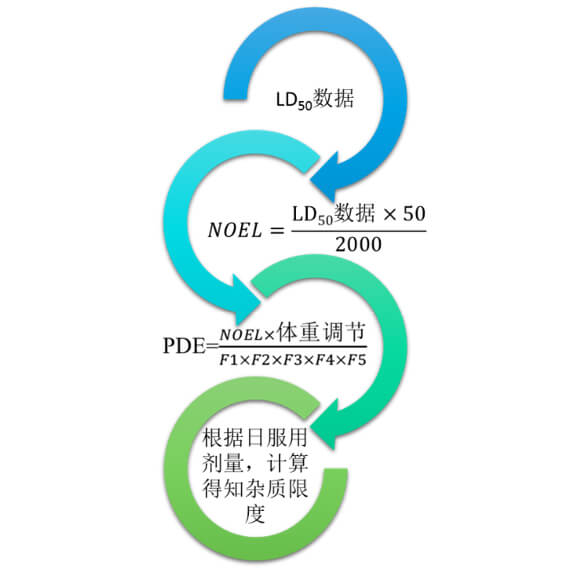
图2:不建议使用的限度制定方式
在清洁验证指南2021版中也提到了,强烈建议限制使用LD50作为启动点,因为对于长期影响的预测是不可信赖的。

图3 源自:APIC清洁验证指南2021版
同时LD50也具有很多局限性:
1、LD50值提供的有效信息较为有限。化学物质的单次大剂量急性毒性,使很多动物死于中枢神经系统及心血管功能障碍,不能很好的显示出其毒作用特征。
2、LD50值不稳定,受多种因素影响。1977年欧洲共同体收集到的80个实验室对5种化学物质的LD50值,结果能相差2~8倍。
3、急性毒性实验所用剂量和临床人用剂量差距较大,不能用急性毒性实验来拟定人多临床计量。
4、人和动物对药物敏感性差距较大。以阿托品为例,小鼠的LD50值是人的致死量的250倍。
基于以上种种原因,不建议使用LD50值进行PDE的计算,在有其他相关研究的情况下,建议优先选用其他的数据。对于未收录的残留溶剂,首先建议查询或预测其基因毒性,如果是基毒,那就是M7的范畴,可用TTC法等进行控制,如果不是基毒,首先建议采用NOEL计算PDE值,如果没有相关数据,可以参照ICH Q3A(新原料药中的杂质)或者结构类似物进行控制。

图4 源自:ICH Q3C
这里分享一些毒理数据查询的网址供大家参考使用,在查询相关毒理学数据时,建议首选官方的研究数据,其次选择实验设计及过程符合GLP或OECD指导原则的实验得到的毒理数据,以上两项都不满足,选择数据披露完整的key study得到的毒理数据。
相关数据查询网站,输入CAS号或者药物英文名进行查询
ToxInfo网站查询:https://www.toxinfo.io
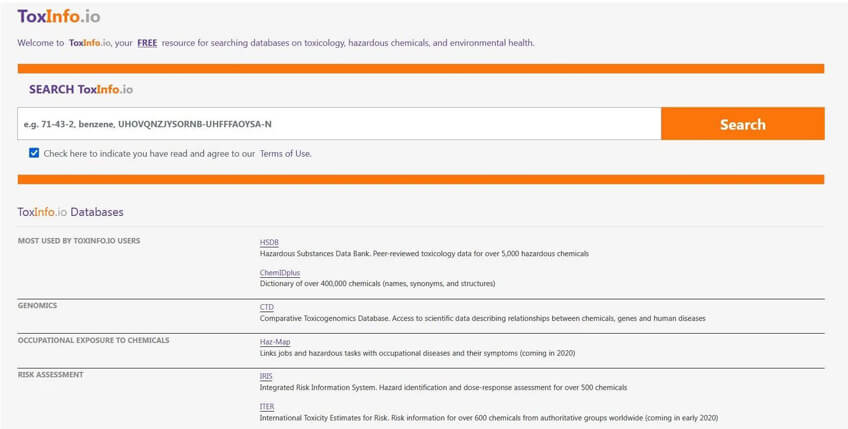
ToxInfo提供了对下列数据库的免费访问检索:
HSDB、ChemIDplus、CTD、CPID、Haz-Map、IRIS、ITER、CCRIS、CPDB、GENE-TOX。通过数据库得到TD50数据后,可以根据以下流程进行计算,得到该溶剂的限度。
其他数据库:
https://www.epa.gov/iris
https://ntp.niehs.nih.gov/等
(撰稿:李墨;编审:毕增)
 相关新闻
相关新闻