2021年11月30日和12月1日,国家药品监督管理局药品审评中心(CDE)连发基因疗法3大指导原则:
❖1. 基因治疗产品非临床研究与评价技术指导原则(试行)
❖2. 基因修饰细胞治疗产品非临床研究技术指导原则(试行)
❖3. 基因治疗产品长期随访临床研究技术指导原则(试行)

图片来源:国家药品监督管理局药品审评中心

图片来源:国家药品监督管理局药品审评中心
随着基因转导和修饰技术、递送载体系统、细胞培养技术等领域在基础研究和技术开发上的快速发展,基因治疗取得了突破进展,为难治性疾病(尤其是罕见遗传性疾病)提供了全新的治疗理念和思路。自基因治疗技术出现以来,安全性始终是基因治疗研发最为关注的问题之一,关系到整个领域技术研发和产业应用的有序发展。基因治疗产品应开展系统的非临床研究,评估安全性风险,验证有效性机制,以支持开展相应临床试验及上市。基因治疗产品种类多样,作用机制和起效方式有别于小分子和大分子药物,非临床试验设计、实施以及研究设计中试验类型、时间安排和灵活性,可能与其它药物的非临床研究不同。
在过去的几十年时间里,科学界一直在尝试使用病毒修改人类DNA,以求获得治愈癌症、罕见遗传病等疾病的可能。因为病毒能够将自身的遗传物质引入到宿主细胞内,并利用宿主的“细胞工厂”持续表达。于是基因治疗迎来了从概念走向现实的关键性突破。但这项工作极具挑战性,有进展,但迟迟没有出现安全有效的基因疗法。
基因治疗
基因治疗的概念最初出现在1960 年代和1970 年代初期。随着重组DNA 技术的出现,克隆基因变得可用,并被用来证明外源基因确实可以在体外纠正哺乳动物细胞中的遗传缺陷和疾病表型。高效的逆转录病毒载体和其他基因转移方法已允许在体外和体内进行有效表型校正,且取得了令人信服的结果,如今,基因治疗已成为一种广泛接受的治疗方法,并证明对患者进行临床应用研究的合理性。
狭义的基因治疗是指将一个正确的基因片段直接导入患者的体内,实现在体的基因增加、修改来治疗疾病。但苦于无法将基因片段或者基因编辑工具在体内有效传递,早年的基因治疗发展一直较缓慢。
广义的基因治疗指通过纠正或补偿异常基因缺陷以达到治疗疾病的一种治疗方法。基因作为遗传物质的基本单位,具有控制遗传性状表达和活性调节的作用。当人类的基因出现异常时往往会出现一些病状。基因治疗可以通过基因转移或基因调控等方法,将带有治疗性的基因导入患者体内,使其正常表达,从而得到治疗的效果。
基因治疗发展历程
基因治疗概念的形成有着非常悠久的历史,随着DNA双螺旋结构发表后,20世纪七八十年代,限制性内切酶、DNA连接酶和逆转录酶等相继被发现,基因重组工程技术得到发展,病毒载体出现,基因治疗的技术体系初步具备。
1972年,美国著名生物学家Theodore Friedmann等人在《Science》上发表了具有划时代意义的前瞻性评论《基因治疗能否用于人类遗传病?》,提出了基因治疗是否可以用于人类疾病治疗的设问。对于这种全新的治疗方法,当时社会的态度更多是质疑。直到1989年,FDA才批准将载体导入作为 “基因标记”的临床试验。1990年才正式批准进入临床试验。历史上首例基因疗法的临床试验是由William French Anderson医生领衔的针对重症联合免疫缺陷病(SCID)的基因治疗。他们首先从4岁女孩Ashanti DeSilva体内抽取白细胞,然后在体外利用逆转录病毒载体将能够正确编码腺苷脱氨酶的ADA基因插入到Ashanti DeSilva的白细胞基因组中,最后将这些基因工程改造后的白细胞重新输回Ashanti DeSilva体内,这一案例在基因治疗发展史上无疑是一个极其重要的里程碑。
然而,到20世纪90年代末,发生了一系列基因治疗引发的不良案例,甚至死亡,导致基因治疗进入寒冬,人们开始对基因治疗进行冷静的思考。
2003年10月16日, Gendicine成功地取得了国家食品药品监督管理局颁发的新药证书、生产批文和药品GMP证书。Gendicine是重组人p53腺病毒注射液,被批准用于治疗头颈部鳞状细胞癌患者。2012年,荷兰UniQure公司的Glybera由欧盟审批通过,用于治疗家族性脂蛋白脂酶缺乏症(LPLD),它的获批上市开启了基因治疗的新时代。2016年,意大利San Raffaele Telethon研究所与葛兰素史克(GSK)公司合作开发的基因疗法Strimvelis实现了18位腺苷脱氨酸缺乏性重度联合免疫缺陷症(ADA-SCID)患儿的完全治愈,同年,Strimvelis获得欧盟的上市许可,使基因治疗技术的商业化迈出重大的一步。2017年12 月,美国公司Spark Therapeutics的基因疗法Luxturna获批上市,成为首款在美国获批、靶向特定基因突变的“直接给药型”基因疗法。2019年5月诺华Zolgensma获FDA批准上市,成为FDA批准的第一个治疗SMA(脊髓性肌肉萎缩)的基因疗法。据FDA预测,到2025年,每年将有20种左右的基因或者细胞疗法进入市场。
但是,在基因治疗产品进入常规临床应用以提供安全的治疗之前,仍有多个问题需要解决。基因治疗在科学研究、安全性的改进,基因转移效率和输注的进一步成熟,最终推动了大量的临床进展。基因治疗目前的研究方向主要集中在基因传递载体、基因编辑等。
基因治疗分类
基因治疗可根据实现手段的不同分为体外(离体)治疗和体内治疗两大类。体内基因治疗和体外基因治疗的研发管线各占一半,病毒仍是最常用的基因载体。采用体内方法还是体外方法由很多因素决定,比如疾病产生部位、体内细胞的获取难度等等,总体来说,体内方法和体外方法没有显著的优劣差异。无论是体内和体外治疗,绝大部分的研发管线都使用病毒载体。目前应用最广泛的平台依次是腺相关病毒、慢病毒、腺病毒等。其中,腺相关病毒(AAV)是一种大小约为26nm,只包含一条单链线状DNA基因和蛋白质衣壳的无包膜病毒。AAV由于其低毒力、高转导率、成本可控、低插入风险的特点被广泛运用于基因治疗中。
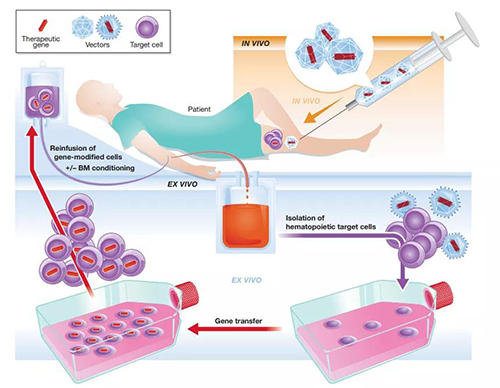
体内和离体基因治疗[2]
基因治疗市场概况
随着医学技术与相关法规的成熟,全球的基因治疗市场将迎来数量级的增长。Evaluate Pharma预测,基因治疗产品的销售额将从2017年的1000万美元增长到 2024年的136亿美元。
目前,基因疗法仍处于发展阶段。随着市场对于创新和优化的需求持续增加,会使得基因治疗的分工更为细化,从而推动各大药企寻求专业的CRO和CDMO服务以降低成本。且与传统药物研发相比,基因疗法需要的研发投入更高。因此在基因疗法研发领域,对于利用专业的外包研发生产团队以降低成本的需求很高。所以,企业的多方位合作在推动基因治疗的管线研究上起到了不容忽视的作用。
展望与挑战
基因治疗有望成为这个世纪的一种重要治疗方法,因为它的影响范围远远超出了传统药物。基因治疗能够促进生物制剂的稳定、持续和受调控的表达。此外,当与细胞疗法相结合时,基因治疗将细胞变成用于靶向基因传递的智能载体。基因治疗可将强大的生物过程导向疾病矫正、组织修复和再生。且可以通过遗传机制传递信息来保证所提供治疗的稳定性、保真度和放大率。人体干细胞的归巢机制可用于将基因疗法靶向特定组织和疾病部位。基因治疗还利用干细胞和移植的再生潜力以及免疫的生物武器,用于特异性消除转化或感染的细胞。通过利用这些内在的生物学能力,基因治疗有可能解决罕见和常见严重疾病的大量未满足的医疗需求,这将使患者得更广泛的受益。
但在实现这一美好愿景之前,仍需面对多项重大挑战。例如,基因转移载体的有效性和安全性应该通过进一步改造它们的设计和组成来提高,这可能需要将不同病毒的生物学特征与合成的分子相结合来评估。这些进步将使载体能够精确靶向组织和细胞类型,并克服细胞对基因转导和绕过外源核酸传感器的限制。还将帮助载体避免激活先天性和适应性免疫系统。总体而言,这些变化还将确保转基因表达是可重复的、稳健的、在较长时期内发生,且与内源性表达模式一致。
此外,由基因的特殊性所引发的伦理、宗教、管理和社会问题也会随之而来。如何对基因治疗技术的研究与发展进行全面的、科学的、合理的评价,已成为这一领域有待解决的重要问题。所以对于基因治疗还需要长久监测治疗的安全性和有效性。
参考文献
[1] T Friedmann. A brief history of gene therapy. Nat Genet. 1992 Oct;2(2):93-8.
[2] Kerstin B Kaufmann, et al. Gene therapy on the move. EMBO Mol Med. 2013 Nov;5(11):1642-61.
[3] Luigi Naldini. Gene therapy returns to centre stage. Nature. 2015 Oct 15;526(7573):351-60.
[4] Stuart H Orkin, et al. Emerging GeneticTherapy for Sickle Cell Disease. Annu Rev Med.2019 Jan 27;70:257-271.
[5] Vivek Sudhakar, et al. Gene Therapy forNeurodegenerative Diseases. Neurotherapeutics. 2019 Jan;16(1):166-175.
[6] Don P Wolf, et al. Principles ofand strategies for germline gene therapy. Nat Med. 2019Jun;25(6):890-897.
[7] Alain Fischer,et al. Genetherapy for severe combined immunodeficiencies and beyond. J Exp Med. 2020 Jan 6;217(2):e20190607.
此次CDE发布的指导原则为基因治疗产品研发提供了建议,以帮助设计合适的非临床研究计划,并作为非临床评价的参考,以支持开展相应的临床试验。
基因治疗产品非临床研究为临床试验提供支持性信息,研究内容一般为
药理学、
药代动力学、
毒理学,用于提供作用机制有效性证据、明确生物分布特点、确定药理作用特征、了解毒理学特征(确定靶器官、暴露量-反应关系和可逆性等)、确定首次人体试验的安全剂量水平、建议临床给药途径和剂量递增计划、支持患者入组标准、确定可指导临床监测的生理参数、提示临床试验风险等。
美迪西基因治疗产品研发服务平台
美迪西临床前研究服务涵盖药效学研究、药物安全性评价、药代动力学研究、生物分析等,建立完善的基因治疗产品研发平台可为细胞与基因治疗类产品提供药理药效、生物分布和安全评价研究的一站式服务。
服务资质
美迪西动物实验设施获得AAALAC(国际动物评估与认证协会)认证和中国食品药品监督管理局GLP证书,并成功通过美国食品药品管理局GLP审计。
服务模块
药物类型
❖细胞治疗类产品
❖溶瘤病毒类产品
❖mRNA类产品
❖寡核苷酸类产品
❖基因编辑类产品
模型资源
❖原位移植肿瘤模型
❖异种肿瘤移植模型
❖同种肿瘤移植模型
❖人源化肿瘤移植模型
❖转基因模型
❖PDX模型
❖其它疾病模型
分析平台
❖核酸水平分析平台
❖qPCR、RT-qPCR、dPCR
❖细胞水平分析平台
❖Cell-counter、FACS、ELISPOT、TCID50
❖蛋白水平分析平台
❖ELISA、FIA、CLIA、ECL、HTRF、RIA、Gyrolab、Bio-plex
先进的仪器设备
❖CytoFLEX 流式细胞仪
❖QIAcuity one 数字PCR仪
❖Luminex、MSD电化学发光分析仪
❖MD SpectraM4/M5、ABI7500 qPCR
❖Covaris E220、Kingfisher

欢迎扫码入群
了解更多美迪西研发和技术平台

或添加美迪西市场部微信名片
联系我们:
电话: +86 (21) 5859-1500(总机)













 相关新闻
相关新闻