



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





生物分析能力是药物临床前研究和临床研究的基石能力,是美迪西这类CRO机构助力国内外客户顺利推进药物开发进程的技术基础。生物分析虽然是一门技术性很强实践性很强的工作领域,如果仅就分析看分析,仅就技术本身思考技术对于研发过程中遇到各种情况和问题的解决可能会带来思路上的局限性。做好生物分析工作,离不开技术实践,更离不开相关基础理论知识的支撑,实践反馈理论,理论指导实践,一些基础理论不仅具指导价值,有时也具启发性,有利于广拓视角。美迪西美研小编团队推出生物分析系列专栏,邀请本领域的资深专业人员从不同的视角笔谈生物分析相关的话题。
目前热门和已上市的核酸药物主要包括mRNA和寡核苷酸两大类,mRNA既可以作为为疫苗,又可以作为治疗性药物,需要差异性地考虑其PK/PD的评估策略;寡核苷酸目前成药的主要是ASO和siRNA,这些核酸药物又兼顾了小分子与大分子药物的一些PK/PD特征。
基因治疗目前有多个不同层面的理解,狭义基因治疗一般定义是使用正常的基因替代、纠正异常的基因,或者将异常的基因敲除以达到治疗疾病的目的。基于中心法则上去理解,狭义的基因治疗也可以从另一个层面定义为通过纠正中心法则过程中出现的问题,如基因突变导致的功能性蛋白质缺失或异常等(参见图1和图2),以达到治疗疾病的目的。在广义的基因治疗概念下,溶瘤病毒、细胞治疗,核酸类药物均可被纳入基因治疗的范畴,但并不是所有的核酸药物都属于基因治疗范畴,如mRNA药物仅有一部分可以被纳入基因治疗的范畴。
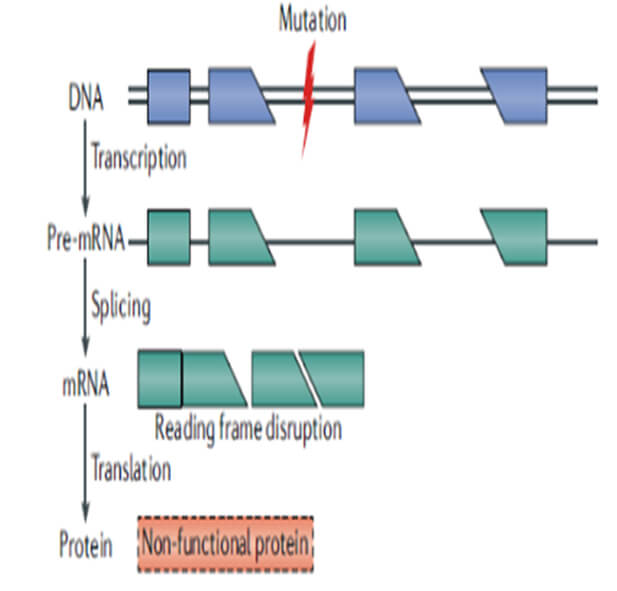
图1. 基因突变影响开放阅读框而不能形成有功能的蛋白
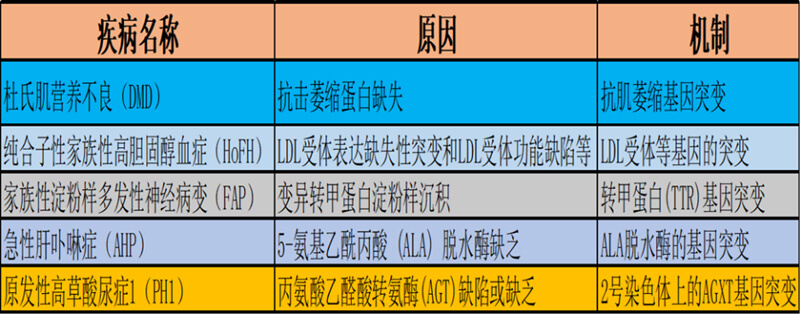
图2. 部分寡核苷酸药物针对的遗传病
目前的基因治疗领域有两个离不开核酸的有趣的现象,即RNA干扰和CRISPR基因编辑。RNA干扰和CRISPR基因编辑也都是一种生物体内抗病毒感染的免疫机制,是在核酸水平上的免疫,有人称其为基因免疫或基因组免疫。而经典的免疫学里涉及的免疫系统中的免疫分子包括抗体、补体、配体、受体和细胞因子等成分一般都是氨基酸为基本组成单元的分子,没有核苷酸作为基本组分的分子的直接参与。
未来是否有更多类似于RNA干扰和基因编辑的核酸层面的机制被发掘而可能会进一步地丰富我们对免疫学的认知,并且在基因组免疫领域的概念会越来越丰富、发展,甚至逐步成为免疫学的一大分支,或许也能作为我们的一种额外期待。
核酸药物经过几十年的积累,在近几年达到了爆发期。目前国内外上市的基因治疗药物主要是mRNA疫苗和主要针对遗传病的寡核苷酸类药物(如图3)。所以本文主要将核酸类药物分为mRNA药物和寡核苷酸药物两类,分别进行简要阐述。
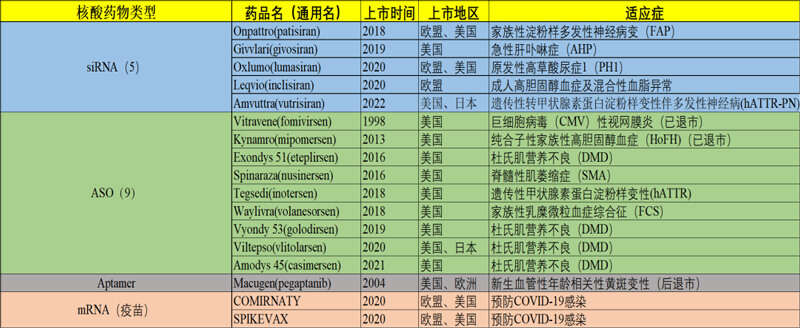
图3. 国际上市的主要核酸类药物(截至2023年3月,暂未列国内厂家产品)
mRNA药物的优势包括:
(1)可以导入细胞,在体内直接表达目的蛋白;
(2)mRNA的降解通过细胞正常代谢完成,无明显的毒性;
(3)既能刺激体液免疫,又能刺激细胞免疫应答;
(4)既可以开发为疫苗,又可以开发为治疗性药物等。
mRNA药物的缺点包括:
(1)不稳定,易被核酸酶等降解;
(2)制备工艺复杂;
(3)使用纯生物药的生产路径;
(4)需要超低温运输等。
制定mRNA产品临床前药代动力学药效学(PK/PD)考察分析策略的前提是判断其属于疫苗还是治疗性药物。两者存在以下不同:
(1)编码蛋白的性质不同,mRNA疫苗编码病毒或肿瘤抗原蛋白,一般少量蛋白表达就可以发挥作用, 治疗性药物则通常需要更高的蛋白表达量;
(2)递送要求不同,疫苗无需组织特异性,mRNA治疗性药物则期望递送到特定的组织后进行翻译表达;
(3)给药方式不同,目前上市和在研mRNA疫苗多为肌肉注射,治疗性药物则根据具体治疗性质常采用系统给药,甚至靶组织局部给药;
(4)遵循的法规不同,mRNA疫苗需要遵循疫苗的指导原则,免疫原性属于其PD指标,而治疗性药物则不同的遵循,免疫原性也非是研发者所期望。
mRNA疫苗可以在细胞内表达病毒或细菌蛋白,刺激机体产生免疫保护性抗体,或者表达肿瘤新生抗原,从而制备个性化肿瘤疫苗。部分mRNA疫苗如针对基因突变产生的肿瘤新生抗原开发的疫苗,可以被认为是基因治疗产品。但另一部分mRNA疫苗表达病毒抗原如新冠疫苗可直接表达SARS-CoV-2的刺突蛋白或刺突蛋白的RBD结构域,诱导机体产生免疫应答,一般不认为是基因治疗产品,故如前所述只是部分mRNA产品属于基因治疗范畴。
mRNA疫苗临床前PK/PD考察分析的要素主要有:
(1)预防用生物制品的指导原则中指出疫苗通常不需要进行常规的药代动力学研究,但某些特殊类型疫苗应需要进行生物分布的研究;
(2)非临床研究中,需要研究mRNA和脂质纳米颗粒(LNPs)或其它脂质成分是否在接种疫苗的组织中分布,它们分布在哪些组织中,以及它们的持续时间。
(3)作为疫苗一般不用分析表达产物,但其表达产物的免疫原性相当于其重要的药效指标。
基于mRNA疫苗的机制和效果,对于免疫原性方面,既要考虑结合抗体又要考虑中和抗体,不仅考虑B细胞免疫还要考虑细胞免疫(参见图4),与治疗性药物相比,mRNA疫苗的免疫原性很强,一般不需要使用高成本高灵敏的检测技术进行结合抗体的检测。
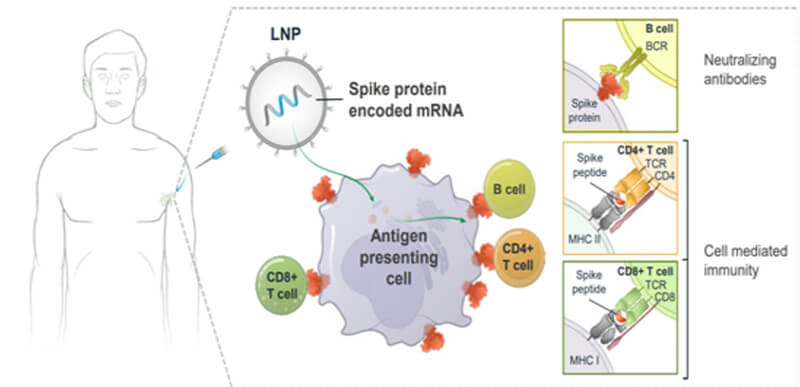
图4. mRNA疫苗作用机制示意图
mRNA治疗性药物有如下效用方式:
(1)抗体效用,即直接表达用于治疗当前和新发疾病的预防性或治疗性抗体;
(2)蛋白替代疗法,即直接表达一种人类蛋白来解决遗传疾病,如血友病;
(3)基因编辑/碱基编辑,即表达基因组编辑蛋白或碱基编辑蛋白来修饰人类基因表达。
mRNA治疗性药物通过编码功能性治疗蛋白,由所表达的蛋白产物发挥治疗作用。该类药物的临床前PK/PD分析需要有以下两个考虑点:
(1)PD的持续与mRNA产物的表达量和表达时相相关,即存在一定的量效关系;
(2)药物的PK研究如吸收和分布的研究有利于评价量效关系。
mRNA治疗性药物的临床前PK/PD分析需要考查的要素有:
(1)PK分析:即mRNA浓度随时间变化的分析;
(2)将表达产物,即目标蛋白的表达量与分布作为PD指标进行分析;
(3)脂质体成分的药代分布分析,尤其是新型脂质辅料。
此外,PK/PD与免疫原性间通常具有关联性,对于mRNA治疗性药物需要同时分析mRNA本身和脂质体成分的免疫原性影响,聚乙二醇化LNP产生抗体已有报道,抗PEG抗体已被广泛研究和报道,笔者所在机构也分析出LNP的PEG成分可见一定程度的免疫原性,笔者所在机构表达IgG1亚型抗体的治疗性mRNA产品在食蟹猴静脉给药的PK/PD试验例中全面兼顾了本文所列要点。
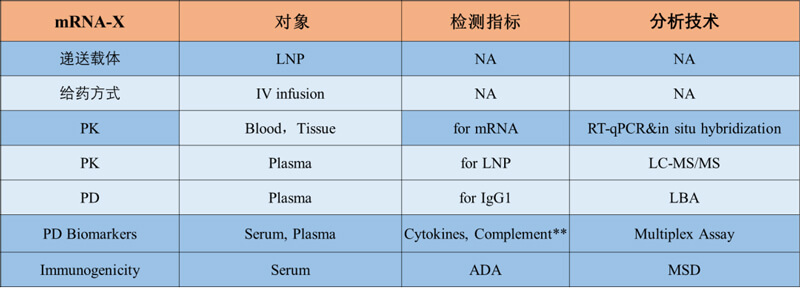
图5. mRNA治疗性药物的PK/PD研究设计实施例
目前寡核苷酸类产品成药上市的主要为反义寡核苷酸(ASO)与siRNA,而miRNA研发进入临床试验的极少,所以本部分的分析仅以ASO与siRNA药物为代表。ASO和siRNA的主要区别在于,前者是单链,后者是双链RNA。而双链的siRNA作用机制与RISC形成有关,RISC可反复作用靶标mRNA; siRNA被释放的正义链或被降解,也可作为引物,在RNA依赖的RNA聚合酶的催化下以靶mRNA为模板扩增得到dsRNA,dsRNA又可被Dicer降解成siRNA,进入RNAi循环,所以药物效果更持久甚至有级联放大效果。
寡核苷酸类药物的PK特征包括:
(1)静脉给药和其它途径给药,药物进入靶部位的方式不同,导致体内的PK过程也不一样;
(2)裸siRNA不稳定,易被血液和组织中核酸酶降解;
(3)容易在肝脏和肾脏中聚集,并经肾脏排泄;
(4)非脑内给药时,不易过脑;
(5)两条链被修饰的方式不一样,导致两条链的PK参数比如峰浓度和暴露量不一致;
(6)在给药局部存留时间长;
(7)血液清除速度要快于组织;
(8)目前的药物基本都为体外合成的RNA分子,可被免疫系统吞噬,有些还会激活天然免疫,如toll样受体参与引发免疫反应,比如干扰素(IFN-α、IFN-β)、细胞因子(TNF-α、IL-6)产生等。寡核苷酸药物主要经核酸内或外切酶代谢为短核苷酸碎片,和蛋白类药物被蛋白酶切割降解为氨基酸类似,所以寡核苷酸药物与传统大分子药物的代谢上有雷同之处,但许多寡核苷酸现实又多见修饰,其代谢产物分析仍需周全考虑;另其分子量是远大于小分子和一些多肽,分子量较大,需要考虑免疫原性潜在的对其PK/PD特征的影响。
寡核苷酸类药物PK/PD考察分析的策略要点主要包括:
(1)按照小分子药物PK研究思路设计相关研究内容;
(2)兼顾其大分子药物的部分特征,考虑免疫原性的影响,如抗药物抗体(ADA)的分析,考虑代谢清除缓慢的特点;
(3)对于siRNA,分析反义链和有义链所表征的PK行为是否有差异;
(4)必要时,注意考察制剂辅料的PK特点;
(5)设置相应PD指标,如新功能蛋白的水平变化;
(6)适当设置细胞因子、补体等PD生物标志物指标,针对辅料如PEG的抗体检测;
(7)利用合适平台技术开发满足实际灵敏度需求且稳定的PK生物分析方法是一大挑战。
分析寡核苷酸类药物的PK/PD,离不开对其免疫原性的察。因为寡核苷酸类药物是外源性核酸分子,分子量偏大,并且是潜在的弱抗原或半抗原。而免疫原性产生的主要原因可能与其产品因素、产品的药理学因素以及给药对象因素有关,药理学因素以及给药对象因素具体机制与其它大分子的这两方面因素大致相同,重点要考虑该类产品潜在引起免疫原性的本身的产品因素的不同如链型、碱基序列、碱基修饰、递送载体成分、骨架修饰等。免疫原性的考察点的考虑基于siRNA等寡核苷酸的外源性性质,宿主系统会将其视为病原体,免疫系统可以通过细胞外和细胞内不同的病原相关分子模式(PAMP)受体识别单链和双链RNA与toll样受体(TLRs)相互作用产生免疫应答;以及TLRs刺激炎症细胞因子和I型干扰素(IFN)的过量产生的免疫反应。既要考虑体液免疫分析,又要考虑除寡核苷酸本身外的载体成分,甚至药效机制发挥而生成的新的功能性蛋白成分的免疫原性。
核酸类药物尤其是寡核苷酸类药物,对生物分析带来了巨大的挑战。寡核苷酸类药物的分子量不大不小、并存在药物不稳定、链型、修饰、弱免疫原或半抗原(导致特异阳性抗体的制备存在现实困难)等特征,这些都是构成其分析挑战的几大因素。
目前主要有5种主流技术可以进行核酸类药物的PK分析,包括PCR技术、H-LBA、b-DNA、基于杂交的LC-UV/PL以及LC-MS/MS和LC-HRMS(图6)。
其中,qPCR技术可以方便地检测长度较长的核酸类药物,灵敏度高,检测范围宽,但是需要复杂的样品处理过程;ddPCR灵敏度更高,但耗材费用高,成本高;对于较短的核酸检测来说,虽然也可以通过茎环qPCR(Stem-Loop qPCR)的设计实现,实施相对于较大的核酸要复杂。H-LBA方法的特异性高,灵敏度好,但是检测效果非常依赖于探针的可靠性和设计技巧及反应过程细节的优化;b-DNA方法其实是H-LBA技术的拓展版,有很高的特异性、准确性和更高的灵敏度,但检测效果同样高度依赖于特殊的探针设计及杂交反应技术细节;基于杂交的LC-UV/FL方法可以测定较长核酸类药物,具备较好的特异性和准确性,但是样品处理复杂,灵敏度对荧光探针的准确性高度依赖;LC-MS/MS和LC-HRMS方法也可以用于核酸类药物的分析,选择性好,可以区分全长和代谢产物,但是对非修饰的寡核苷酸类药物检测灵敏度和特异性相对较差,并且价格昂贵,不适宜测过长的核酸分子。其它的活体荧光成像,同位素示踪、原位杂交、荧光原位杂交等分析技术可以作为补充手段,应用于不同的目的和研究阶段,但它们的精准度差,不大适合作为后续的验证用方法。
图6. 核酸类药物生物分析的主流技术对比
近年来,核酸类药物是近几年来最热门一大新药研究方向。但核酸类药物尤其是寡核苷酸类药物与传统小分子与大分子药物成分存在显著区别,给核酸类药物的生物分析和PK/PD考察带来了较大的技术挑战。mRNA药物作为疫苗和治疗性药物时考虑点不同,寡核苷酸类药物同时兼顾了大小分子的一些PK/PD特征,需要根据具体的分子特征选择PK/PD考察评估策略和分析的技术应用策略。
[1]. Sun, H., et al., mRNA-Based Therapeutics in Cancer Treatment. Pharmaceutics, 2023. 15(2).
[2]. Takakusa, H., et al., Drug Metabolism and Pharmacokinetics of Antisense Oligonucleotide Therapeutics: Typical Profiles, Evaluation Approaches, and Points to Consider Compared with Small Molecule Drugs. Nucleic Acid Therapeutics, 2023.
[3]. Munter, R., et al., Studying how administration route and dose regulates antibody generation against LNPs for mRNA delivery with single-particle resolution. Mol Ther Methods Clin Dev, 2023. 29: p. 450-459.
[4]. Mu, R., et al., Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics. BioDrugs, 2022. 36(2): p. 181-196.
[5]. Nonclinical Testing of Individualized Antisense Oligonucleotide Drug Products for Severely Debilitating or Life-Threatening Diseases; Draft Guidance for Sponsor-Investigators; Availability. 2021, Federal Information & News Dispatch, LLC: Washington. p. 22213.
[6]. Krienke, C., et al., A noninflammatory mRNA vaccine for treatment of experimental autoimmune encephalomyelitis. Science, 2021. 371(6525): p. 145-153.
[7]. Bioanalytical Methods and Strategic Perspectives Addressing the Rising Complexity of Novel Bioconjugates and Delivery Routes for Biotherapeutics.
[8]. Hirabayashi, Y., et al., Considerations of the Japanese Research Working Group for the ICH S6 & Related Issues Regarding Nonclinical Safety Assessments of Oligonucleotide Therapeutics: Comparison with Those of Biopharmaceuticals. Nucleic Acid Therapeutics, 2021. 31(2): p. 114-125.
[9]. 预防用生物制品临床前安全性评价技术审评一般原则.NMPA, 2005.
[10]. 治疗用生物制品非临床安全性评价指导原则.NMPA, 2007.
[11]. 彭双清,郝卫东. 药物安全性评价关键技术[M]. 北京: 军事医学科学出版社, 2013.
[12]. Evaluation of the quality, safety and efficacy of messenger RNA vaccines for the prevention of infectious diseases: regulatory considerations. WHO, 2021.