



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




全球ADC药物研发和投资热度不断升级。因其良好的靶向性和明显的临床疗效,ADC已经成为抗体药物研发的前沿。随着技术的进步,ADC不仅在结构上已突破经典的抗体+连接子+小分子毒素模式,核素偶联药物、多肽偶联药物、双环肽偶联、抗体-siRNA偶联物、多靶点ADC等新型XDC药物风起泉涌;且从肿瘤治疗领域扩疆拓土到自身免疫疾病等其他创新领域。
ADC药物结构复杂多样化,体内作用及代谢过程复杂性,这些为CMC研究、临床前研究等带来多重挑战。不同的肿瘤微环境不同,靶蛋白不同,对于ADC药物来说选用何种抗体、有效载荷、连接子、连接方式等都需要进行特异性考虑。泛偶联时代,每一款偶联药物,都应该结合自身特点找准定位,形成差异化竞争策略,走创新化的研发之路,满足未被满足的临床需求。
抗体药物偶联物 (ADC) 是一种将高选择性的抗体 (Antibody) 和强细胞毒性的有效载荷 (Payload) 通过连接子 (Linker) 偶联而获得的药物。ADC经典有效载荷通常是有效的抗有丝分裂细胞毒素或DNA烷化剂或具有其他细胞杀伤机制的试剂。ADC结合了单抗对肿瘤细胞的靶向性以及细胞毒性药物的强大肿瘤杀伤力,且克服了单抗的细胞毒性弱和细胞毒性药物系统毒性大的问题,具有1+1>2的治疗优势。
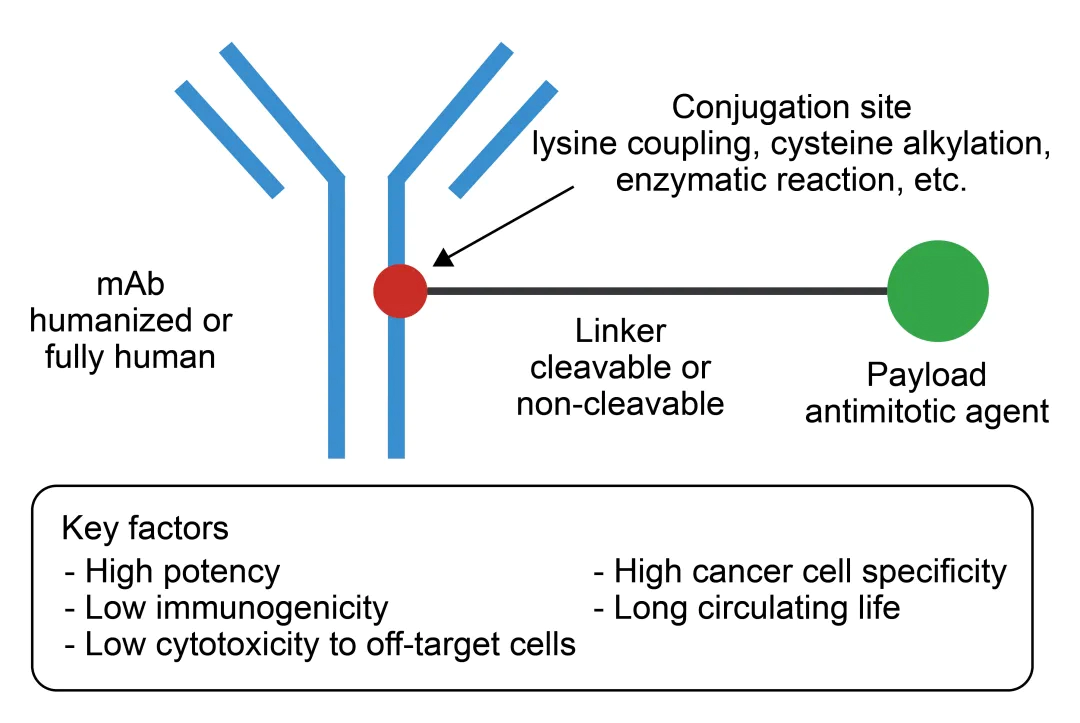
ADC药物结构[1]
目前,许多ADC药物已显示出治疗难治性肿瘤的活性,从而获得了众多不同适应症的批准。然而,它们的更广泛应用受到各种挑战的限制,包括毒性、预测性生物标志物等等。ADC的功效取决于抗体特异性、连接子特异性和有效载荷特异性等多种因素,每种因素都影响着ADC与肿瘤各组分及肿瘤微环境 (TME) 之间复杂的相互作用。
鉴于有效载荷、连接子和偶联方法的改进,ADC的开发在过去十几年中取得了显著进展。特别是连接子的设计对调节ADC在体循环中的稳定性和肿瘤中的有效载荷释放效率方面起着关键作用,从而影响ADC的药代动力学 (PK)、药效和毒性等特征。
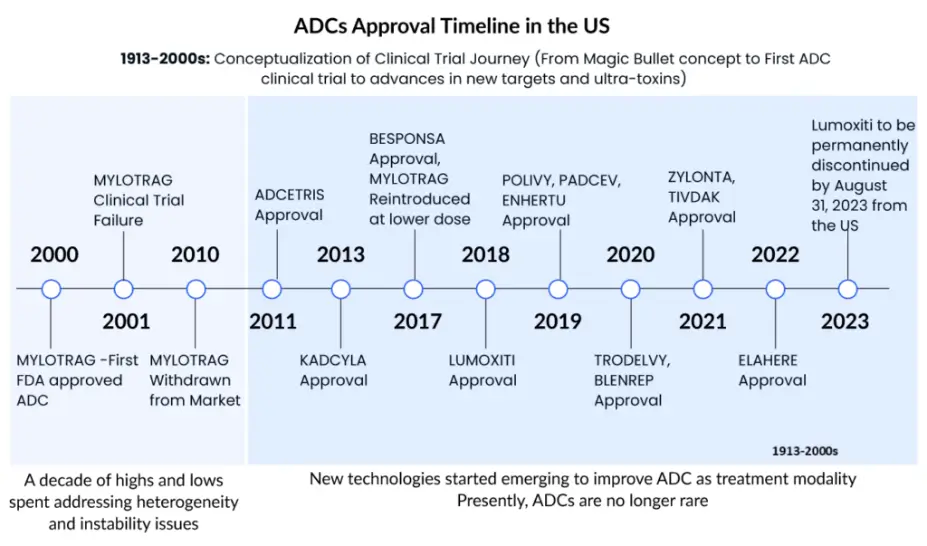
以靶向CD33的吉妥珠单抗 (Mylotarg™) 为代表,使用鼠源或嵌合人源化抗体,连接子不稳定,小分子毒素毒性低且是随机偶联,因而有效性不高,不足以杀死肿瘤细胞;毒素在血浆中提前释放而导致严重的毒性反应,所以毒副作用较大。
以靶向CD30的维布妥昔单抗 (Adcetris®) 和靶向HER2 的恩美曲妥珠单抗 (Trastuzumab emtansine;T-DM1) 为代表,使用人鼠嵌合抗体、人源化单抗,采用毒性更高的细胞毒素和更稳定的连接子,抗体的靶向性更好;但药物/抗体比率 (DAR) 不均一,降低了疗效;且随机偶联造成的脱靶毒性仍继续存在。
以靶向HER2的德曲妥珠单抗 (Trastuzumab deruxtecan;DS-8201) 为代表,使用完全人源化的抗体、高毒性小分子毒素及定点偶联技术,将不可裂解连接子升级为可裂解连接子,药物抗体比高达8,具有更好疗效,但毒副作用仍存在。在多个临床试验中发现了DS-8201有引发间质性肺炎的概率,因此被FDA黑框警告。2019年,DS8201获得FDA批准用于HER2阳性乳腺癌的后线治疗。第三代ADC药物 DS-8201给肿瘤治疗领域,尤其是靶向HER2低表达/HER2突变的肿瘤治疗带来了革命性的突破。
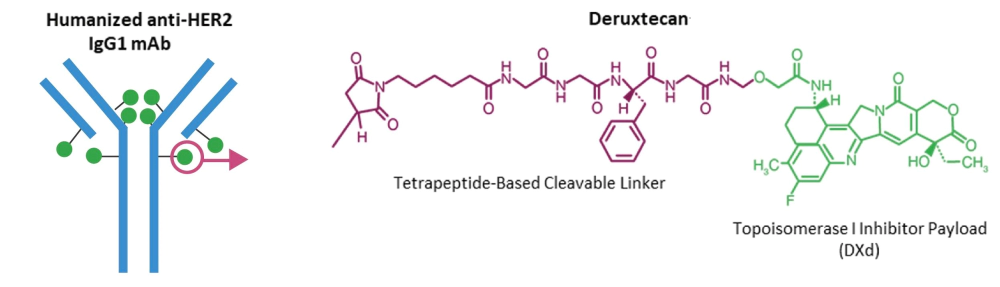
Trastuzumab deruxtecan (DS-8201) 结构[2]
要解决前面3代ADC的耐药问题,就需要新的ADC药物具备更大的治疗窗。比如从抗体、有效载荷、连接子、偶联技术等多方面进行优化。具备更多新技术加持的第四代ADC,再结合适当的转化医学研究势必会为肿瘤研究带来更多的突破。
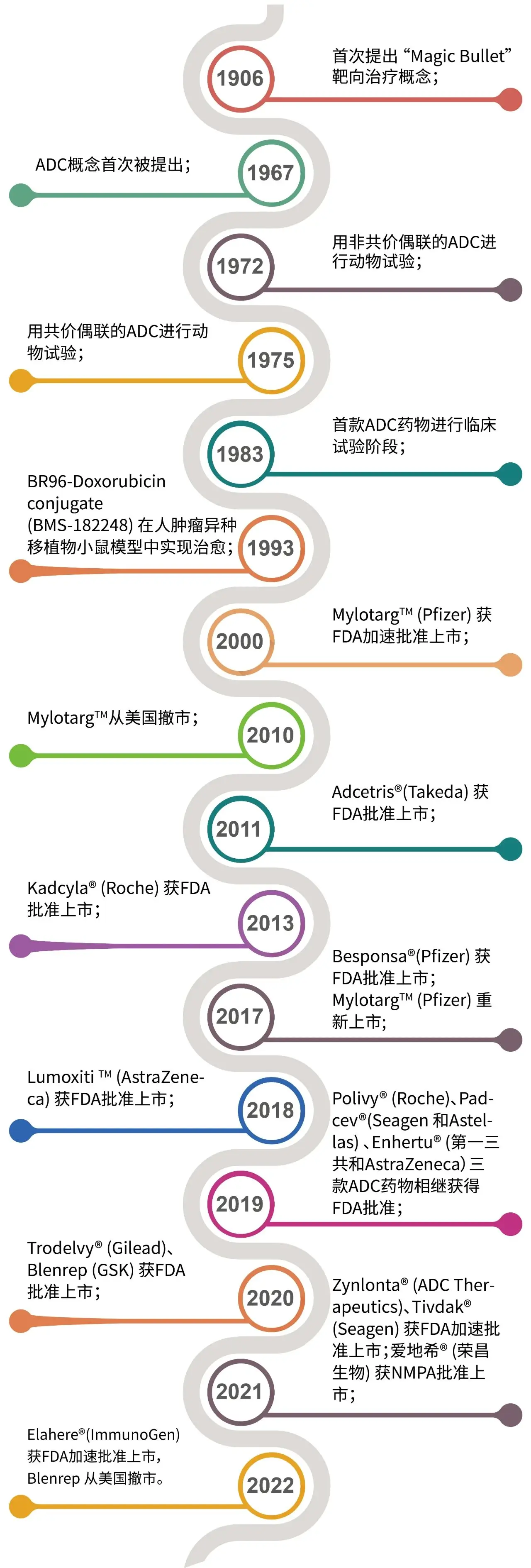
目前全球共有15款ADC药物获批上市,用于治疗血液恶性肿瘤和实体瘤。此外,超过400种ADC药物正处于不同的研发阶段。
较为热门的靶点包括:CD22、HER2、EGFR、Trop-2、BCMA、Nectin-4等。
以肿瘤为主,其次是自身免疫性疾病、细菌感染、湿性年龄相关性黄斑变性等。肿瘤主要为乳腺癌、肺癌、胃癌等。
目前绝大多数的研发项目均处于早期阶段。主要集中在临床前期和临床Ⅰ期。
ADC的作用机制复杂,通常需要药物内化,然后进行细胞内处理和有效载荷释放。
ADC作用的典型模型假设如下:抗体与目标抗原的结合,随后内化,经内体运输进入溶酶体,在溶酶体中ADC的连接子或抗体部分降解并释放出有效载荷,有效载荷则进一步发挥作用产生细胞毒性进而杀死肿瘤细胞。但实际情况更为复杂,并且ADC之间存在明显差异。
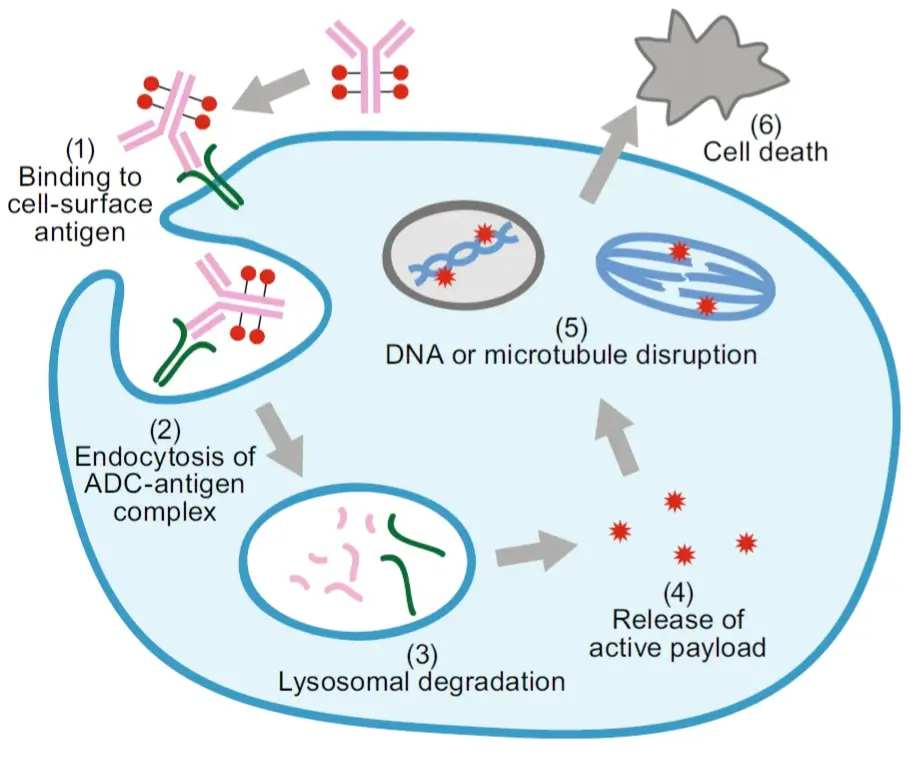
ADC药物作用机制 [1]
靶抗原的选择是ADC药物设计的关键一环。需满足:
1. 特异性,肿瘤细胞高表达、正常细胞低表达或不表达;
2. 靶抗原需为肿瘤细胞表面抗原;
3. 高效诱导内在化过程等。
理论上ADC药物可在肿瘤细胞外释放毒素,不经过细胞内在化,通过“旁观者效应”对肿瘤细胞造成杀伤。但实际上目前大部分ADC药物疗效的实现均是以内在化后的药物释放为基础。因此,ADC药物中的抗体和肿瘤细胞表面抗原结合后,ADC-抗原复合物需能有效诱导内在化过程,进入肿瘤细胞内,并通过适当的细胞内转运和降解过程,实现小分子药物的有效释放。
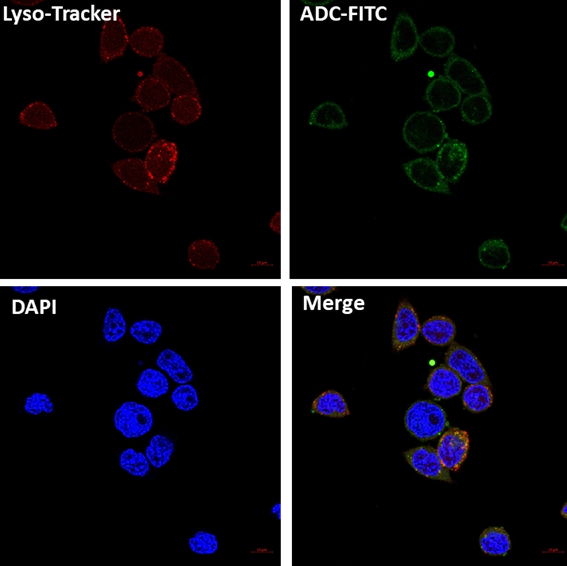
通过细胞免疫荧光Confocal检测ADC内在化
基于抗体的药物出现,使得肿瘤、自身免疫性疾病、心血管疾病、良性血液病和骨骼疾病等多种疾病的治疗取得了实质性进展。抗体片段和双特异性抗体为创新疗法提供了很有潜力的治疗前景。抗体需要满足高特异性、强靶点结合能力、低免疫原性、低交叉反应活性,以达到肿瘤细胞对ADC药物更高效的摄入和ADC药物在血清中更长的半衰期。
免疫球蛋白G (IgG) 是ADC中使用的主要抗体骨架。所以,临床和临床前研究的ADC药物通常选择IgG作为靶向目的抗原的抗体。IgGs可分为四个亚型:IgG1、IgG2、IgG3和IgG4 。其中,IgG1由于能够较好地平衡长血液半衰期和强免疫激活的关系,并且有着较高的自然丰度,是被研究和采用最多的ADC抗体。IgG4由于较低的免疫激活效应也经常被采用在一些对免疫原性反应要求较高的ADC药物设计中。
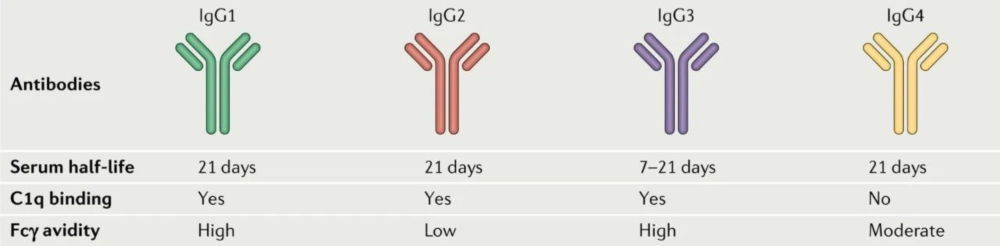
不同IgG对比[3]
早期的ADC药物设计旨在携带具有已知抗肿瘤活性的传统化疗药物,例如甲氨蝶呤、多柔比星或长春花生物碱。然而,这些ADC并不比它们的小分子细胞毒性药物更有效,有时需要极高的活性剂量,这反而增加了毒性。
数据表明,只有很小一部分肿瘤靶向的抗体的给药剂量到达肿瘤组织,这意味着需要具有更大细胞毒性的有效载荷才能实现治疗效果。对携带高效化疗药物(如澳瑞他汀类、卡奇霉素类、美登素类和喜树碱类似物)的ADC进行实验,这些高效化疗药物在亚纳摩尔浓度下可能具有细胞毒性。
澳瑞他汀包括单甲基澳瑞他汀 E (MMAE) 和单甲基澳瑞他汀 F (MMAF),是微管去稳定剂。卡奇霉素,如奥佐米星,是一种DNA结合化合物,可导致双链DNA断裂。美登素类化合物,例如DM1,来源于美登素,并与微管蛋白结合,从而破坏微管动态不稳定性。喜树碱类似物,包括依喜替康衍生物DXd和伊立替康代谢物SN-38,可抑制拓扑异构酶 I (TOPO1),导致DNA断裂。
选择小分子药物时,首先要求小分子药物IC50值低至纳摩尔级别乃至皮摩尔级别。除需要较低的IC50值以外,通常还需要小分子药物包括以下几点:
1. 在与抗体偶联后不易引起ADC药物发生聚集,以保证在体内拥有较长的循环时间;
2. 本身以及形成后的ADC药物需具有较低的免疫原性;
3. 在水溶液(血液)中足够稳定且具有合适的反应位点通过连接子与抗体偶联,偶联后仍然能够保证其生物活性;
4. 可以通过相对具有经济效益的过程合成。
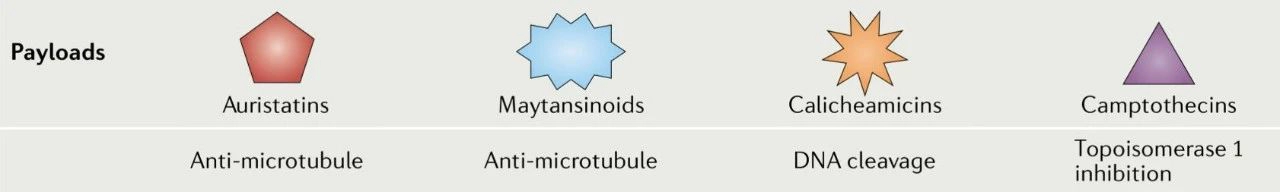
ADC药物的有效载荷[3]
自ADC开发早期以来,连接子技术取得了长足的进步。理想的连接子应在血液循环中十分稳定,以避免小分子毒素提前释放损伤正常的组织或细胞。同时,在肿瘤细胞内需能快速且有效地释放有效载荷。
连接子的设计具有双重目的:
1. 确保当药物在血浆中循环时,细胞毒性有效载荷仍然牢固地附着在抗体部分上。在血浆中不稳定的连接子可能会过早释放有效载荷,导致过度的全身毒性和肿瘤部位抗原接合时有效载荷的传递减少。考虑到许多ADC携带具有毒性特征的高效细胞毒性有效载荷,这使得它们不适合全身给药,因此这个问题尤其重要。
2. 确保有效载荷在肿瘤内有效释放,尤其是在癌细胞内。不能正确传递其有效载荷的ADC则失去了相对于裸抗和传统细胞毒性药物的独特优势。
连接子主要有两种类型:可裂解型 (cleavable) 和不可裂解型 (non-cleavable)。
连接子需要考虑稳定性和释放效率的平衡。不可裂解连接子更具稳定性优势,可裂解连接子释放效率更高。可裂解型的连接子又可以分为:酸可裂解的、可还原的和蛋白酶可裂解的。
不可裂解连接子的实例包括:硫醚连接子(如在T-DM1中使用)和基于马来酰亚胺的连接子(如在 Belantamab mafodotin 中使用)。在实际使用中,可裂解连接子在循环中表现出不同程度的稳定性,并且会随着时间在血浆中降解。相比之下,不可裂解的连接子在血浆中往往更稳定,但依赖于整个抗体-连接子构建体的溶酶体降解来释放其有效载荷,通常导致有效载荷上带电氨基酸的保留,这可能会影响其作用或细胞通透性。
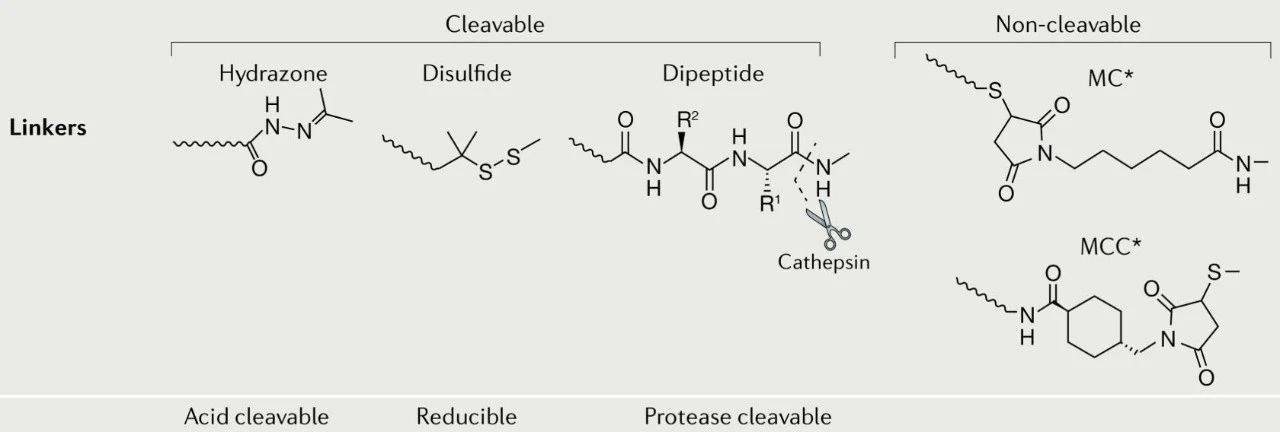
ADC药物的连接子[3]
偶联技术通过连接子将抗体和有效载荷连接到一起,涉及化学反应、抗体修饰与改造等相关技术。
ADC药物所采用的偶联技术与其最终的药物抗体比率(Drug to Antibody Ratio;DAR)密切相关,而DAR的数值及其分布会显著影响ADC药物性质。
DAR是连接到每个mAb的有效载荷部分的平均数量,可通过HPLC-MS等测试方法获得。DAR对药物药理学和活性有影响,DAR值对ADC药物研发后期阶段是必不可少的。ADC药物在体内循环过程中被肿瘤细胞摄入数量有限,因此通常较高的DAR有利于提高效力。然而ADC药物中采用的小分子药物有着较强的疏水性,DAR值过高时会引起ADC药物聚集,导致在体内循环半衰期减少以及毒副作用提高,这就导致过高的DAR不可取,临床前和临床用ADC一般DAR值在2-8范围。
为获得更高DAR以及均一性的ADC药物,可通过基因工程对抗体进行改造使抗体具有数量固定并且高效的反应位点用于偶联小分子药物。
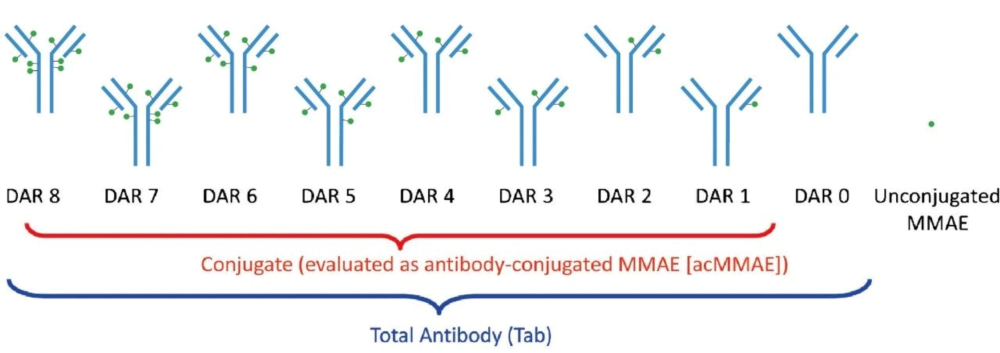
药物抗体比 (DAR) [4]
ADC生产制备流程复杂,整体工艺与质控体系研发能力非常关键。ADC药物生产制造流程包括抗体生产、细胞毒药物/连接子生产、ADC原料药和制剂生产三大模块,均须进行工艺开发与验证,还须对所用工程细胞、起始原料及试剂制定合理的质量控制要求。
偶联生产用中间体的质量控制较为灵活,考验整体工艺与质控体系研发能力。由于抗体和细胞毒素有着不同的生物物理化学性质,例如分子大小以及疏水性等差异,ADC药物生产面临着巨大的挑战。工艺表征研究对后续工艺性能确认批次具有非常重要的导意义。
ADC药物的CMC研究主要包括4部分:1. 抗体;2. 载荷-连接子中间体;3. ADC原料药;4. 制剂部分。
同时,还需要引入一些特殊的质量控制指标。如药物与抗体的比率,载荷与抗体的连接位点以及ADC药物中的药物负载分布等。此外,ADC中游离的载荷和抗体需要进行量化控制,载荷连接抗体后对抗体和靶点结合效力的影响以及ADC在人体血浆中的稳定性也需要进行研究。
当下阶段,ADC对临床肿瘤的治疗格局已经产生了深远影响,在追赶研发浪潮的同时,也需审慎关注研发技术难关。由于ADC的复杂性和多样性,以及生物样本中释放的细胞毒药物含量较低等原因,对药代动力学 (PK) 和药效学 (PD) 表征提出了独特的挑战。此外,在安全性评价中生物分析方法的选择和检测的准确性也是考量要素。
近年来,ADC药物领域发展很快,越来越多ADC药物获批激发了医药人对ADC的研发热情。无论是欣欣向荣的Biotech们还是根深叶茂的Biopharma们,都需要找到自己在该赛道的最佳位置,关注自身优势,差异化发展核心竞争力,推动更多更高效更低副作用的ADC药物获批上市。
随着抗体的发展、连接子不断的优化、高活性有效的发掘和偶联技术的不断完善,高效低毒的ADC药物将会不断涌现。如果能够更好地理解和利用ADC与肿瘤相互作用的微妙之处,则ADC技术的真正潜力会更好地发挥和更广泛地应用,最终可能对肿瘤患者的治疗产生变革性影响。
[1] Kyoji Tsuchikama, et al. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018Jan;9(1):33-46.
[2] Ibrahim Azar, et al. Spotlight on Trastuzumab Deruxtecan (DS-8201, T-DXd) for HER2 Mutation Positive Non-Small Cell Lung Cancer. Lung Cancer (Auckl). 2021 Oct 7; 12:103-114. doi: 10.2147/LCTT.S307324.
[3] Joshua Z Drago, et al. Unlocking the potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):327-344.
[4] Dan Lu, et al. Semi-mechanistic Multiple-Analyte Pharmacokinetic Model for an Antibody-Drug-Conjugate in Cynomolgus Monkeys. Pharm Res. 2015Jun;32(6):1907-19.
美迪西在ADC的临床前一体化研究方案制定中与客户深入交流,科研骨干将每一个案例的特点与多年实战经验和技术积累相结合,谨慎地将优质实验方案与结果提交到客户手上。美迪西可以为客户提供ADC Payloads合成、ADC药物偶联、ADC药效学评价、ADC药代动力学评价和ADC安全性评价等服务。截至目前,美迪西承接的IND申报类生物药大项目已经100多项,包括单抗、双抗、多抗、ADC、病毒疫苗和融合蛋白等。
截至2024年8月,美迪西已成功助力28个ADC药物获批临床,并有20+ADC项目在研。
ADC药物的生物分析远比传统药物复杂。研究需同时表征抗体、连接子(Linker)、小分子毒素(Payload)及代谢产物等组分,以确保研发数据的完整性和科学性。
查看更多在临床前研发阶段,ADC药物的药代动力学研究至关重要。科研人员需重点关注抗体分布、药物释放与细胞内代谢等环节,以确保模型构建科学合理,为ADC研发提供可靠的数据支持。
了解更多ADC药物的作用机制涉及内化、溶酶体降解与胞内释放等过程,增加了PK/PD研究的复杂性。如何科学设计毒代动力学实验并选择合适的动物模型,来预测ADC药物临床风险?
了解更多美迪西提供系统化的ADC药物评价服务,涵盖分子设计、体外功能评估和体内药效验证等环节,为客户研发高效、安全的ADC靶向药物提供一站式支持。
查看更多ADC药物结构复杂,其体内机制与代谢过程给研发带来挑战,如脱靶毒性、疗效不稳定和耐药性问题。体外药效评价是探索并解决这些研发难题的重要环节。
查看更多 相关新闻
相关新闻时间:2020年12月09-10日
地点:上海浦东绿地铂骊酒店
时间:2018年10月25日 14:00-16:00
地点:大兴区北京亦庄生物医药园咖啡厅