抗体药物偶联物(ADC)是近年来肿瘤治疗研究的焦点。ADC 的作用机制很复杂,通常需要药物内化,然后进行细胞内处理和有效载荷释放。与肿瘤学中使用的许多标准疗法不同,ADC 必须作用于肿瘤细胞才能获得最佳效果。ADC 的药效学特性使其特别适合用于治疗难治性癌症。所以,ADC理所当然地成为肿瘤学中增长较快的药物类别之一。
美迪西拥有高水准的专业技术和丰富的ADC项目经验,可为国内外客户提供符合中国和美国新药申报要求的临床前药效、药代动力学和安全性评价服务以及一体化的IND申报注册服务。
>>更多阅读:美迪西ADC临床前研究解决方案

ADC药物简介
目前,许多 ADC药物已显示出治疗难治性癌症的活性,从而获得了众多不同适应症的批准。然而,它们的更广泛应用受到各种挑战的限制,包括毒性、预测性生物标志物等等。ADC 的功效取决于抗体特异性、连接子特异性和有效载荷特异性因素,每个因素影响着 ADC 与肿瘤各组分及肿瘤微环境 (TME) 之间复杂的相互作用。
近几年,ADC 药物不断取得突破性进展。ADC 药物的研发也进入了黄金时代。未来 5-10 年 ADC 药物的全球市场销售额将会达到近200亿美元。
ADC结构及作用机制
抗体药物偶联物 (ADC) 包括三个主要成分:抗体(antibody)、连接子 (linker)和有效载荷 (payload)。
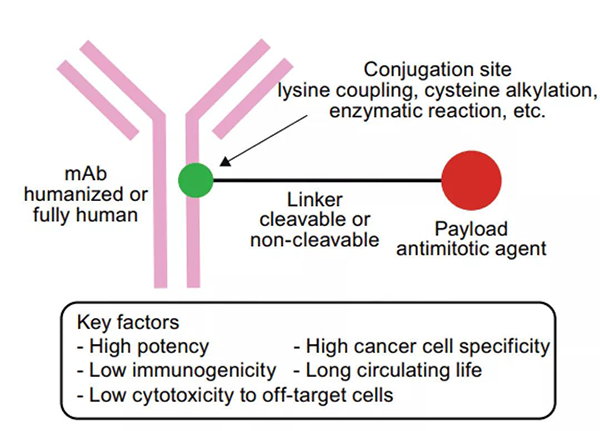
ADC药物结构[1]
ADC 作用的典型模型假设如下:mAb 与目标抗原的结合,随后内化,经内体运输进入溶酶体,在溶酶体中ADC的连接子或抗体部分降解并释放出有效载荷,有效载荷则进一步发挥作用产生细胞毒性进而杀死肿瘤细胞。但实际情况更为复杂,并且 ADC 之间存在明显差异。
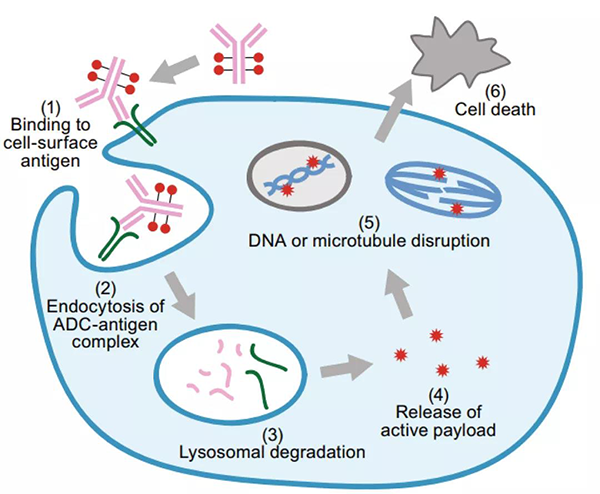
ADC药物作用机制[1]
抗体
基于抗体的药物出现使得癌症、自身免疫性疾病、心血管疾病、良性血液病和骨骼疾病等多种疾病的治疗取得了实质性进展。抗体片段和双特异性抗体为创新疗法提供了很有潜力的治疗前景。抗体需要满足高特异性、强靶点结合能力、低免疫原性、低交叉反应活性,以达到肿瘤细胞对ADC药物更高效的摄入和ADC药物在血清中更长的半衰期。免疫球蛋白 G (IgG) 是ADC 中使用的主要抗体骨架。所以,临床和临床前研究的ADC药物通常选择IgG作为靶向目的抗原的抗体。
IgGs 可分为四个亚型:IgG1、IgG2、IgG3 和 IgG4 。其中, IgG1由于能够较好地平衡长血液半衰期和强免疫激活的关系,并且有着较高的自然丰度,是被研究和采用最多的ADC抗体。IgG4由于较低的免疫激活效应也经常被采用在一些对免疫原性反应要求较高的ADC药物设计中。
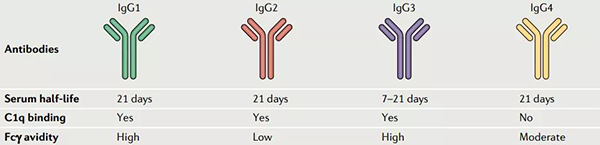
不同IgG对比[2]
有效载荷(Payloads)
早期的
ADC药物设计旨在携带具有已知抗癌活性的传统化疗药物,例如甲氨蝶呤、多柔比星或长春花生物碱。然而,这些 ADC 并不比它们的小分子细胞毒性药物更有效,有时需要极高的活性剂量,这反而增加了毒性。数据表明,只有很小一部分肿瘤靶向的 mAb 的给药剂量到达肿瘤组织(大约 0.1%),这意味着需要具有更大细胞毒性的有效载荷才能实现治疗效果。对携带高效化疗药物(如澳瑞他汀类、卡奇霉素类、美登素类和喜树碱类似物)的 ADC 进行实验,这些高效化疗药物在亚纳摩尔浓度下可能具有细胞毒性。
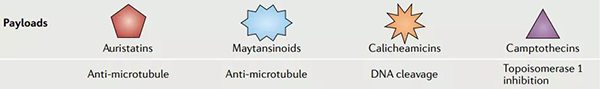
ADC 药物的有效载荷[2]
小分子药物的选择
澳瑞他汀包括单甲基澳瑞他汀 E (MMAE) 和单甲基澳瑞他汀 F (MMAF),它们是微管去稳定剂。卡奇霉素,如奥佐米星,是一种 DNA 结合化合物,可导致双链 DNA 断裂。美登素类化合物,例如 DM1,来源于美登素,并与微管蛋白结合,从而破坏微管动态不稳定性。喜树碱类似物,包括依喜替康衍生物 DXd 和伊立替康代谢物 SN-38,可抑制拓扑异构酶 I (TOPO1),导致 DNA 断裂。
现在选择小分子药物时首先要求小分子药物 IC50值低至纳摩尔级别乃至皮摩尔级别。除需要较低的 IC50值以外,通常还需要小分子药物还包括以下几点:
1.在与抗体偶联后不易引起ADC药物发生聚集以保证在体内拥有较长的循环时间;
2.本身以及形成后的ADC药物需具有较低的免疫原性;3.在水溶液(血液)中足够稳定且具有合适的反应位点通过连接子与抗体偶联,偶联后仍然能够保证其生物活性;5.可以通过相对具有经济效益的过程合成。
连接子(Linkers)
自 ADC 开发早期以来,Linker 技术取得了长足的进步。Linker的设计具有双重目的:
1、确保当药物在血浆中循环时,细胞毒性有效载荷仍然牢固地附着在抗体部分上。在血浆中不稳定的连接子可能会过早释放有效载荷,导致过度的全身毒性和肿瘤部位抗原接合时有效载荷的传递减少。考虑到许多 ADC 携带具有毒性特征的高效细胞毒性有效载荷,这使得它们不适合全身给药,因此这个问题尤其重要。
2、确保有效载荷在肿瘤内有效释放,尤其是在癌细胞内。不能正确传递其有效载荷的 ADC 则失去了相对于裸抗和传统细胞毒性药物的独特优势。
理想的连接子应在血液循环中十分稳定,以避免小分子毒素提前释放损伤正常的组织或细胞。同时,在肿瘤细胞内需能快速且有效地释放有效载荷。
连接子主要有两种类型:可裂解型 (cleavable)和不可裂解型 (non-cleavable)。
可裂解型的连接子又可以分为:酸可裂解的、可还原的和蛋白酶可裂解的。
不可裂解连接子的实例包括硫醚连接子(如在 T-DM1 中使用)和基于马来酰亚胺的连接子(如在 Belantamab mafodotin 中使用)。在实际使用中,可裂解连接子在循环中表现出不同程度的稳定性,并且会随着时间在血浆中降解。相比之下,不可裂解的连接子在血浆中往往更稳定,但依赖于整个抗体 - 连接子构建体的溶酶体降解来释放其有效载荷,通常导致有效载荷上带电氨基酸的保留,这可能会影响其作用或细胞通透性。
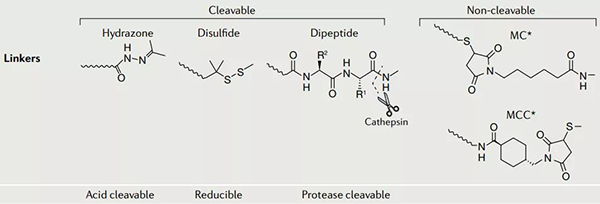
ADC 药物的连接子[2]
美迪西可以对高细胞毒的分子设计以糖取代 PEG 为水溶性的连接子(Linker),能快速制备高细胞毒的化合物、双功能团的连接子,实现快速与毒素、抗体连接。
药物抗体比(DAR)
药物抗体比 (DAR) 是连接到每个 mAb 的有效载荷部分的平均数量,可通过HPLC-MS等测试方法获得。DAR对药物药理学和活性有影响,DAR值对ADC药物研发后期阶段是必不可少的。ADC药物在体内循环过程中被肿瘤细胞摄入数量有限,因此通常较高的DAR有利于提高效力。然而ADC药物中采用的小分子药物有着较强的疏水性,DAR值过高时会引起ADC药物聚集,导致在体内循环半衰期减少以及毒副作用提高,这就导致过高的DAR不可取,临床前和临床用ADC一般DAR值在2-8范围。为获得更高DAR以及均一性的ADC药物,可通过基因工程对抗体进行改造使抗体具有数量固定并且高效的反应位点用于偶联小分子药物。
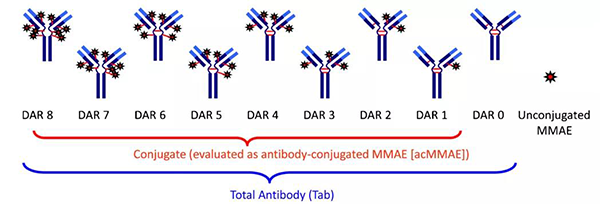
药物抗体比 (DAR)[3]
总结与展望
ADC 作为一种新型靶向的抗癌药物,结合抗体和小分子药物两者优点,拥有巨大的市场前景。随着抗体的发展、连接子不断的优化、高活性载荷的发掘和偶联技术的不断完善,高效低毒的 ADC 药物将会不断涌现。如果能够更好地理解和利用 ADC 与肿瘤相互作用的微妙之处,则ADC技术的真正潜力会更好地发挥和更广泛地应用,最终可能对肿瘤患者的治疗产生变革性影响。
参考文献
[1] Kyoji Tsuchikama,et al. Antibody-drug conjugates: recentadvances in conjugation and linker chemistries. Protein Cell. 2018Jan;9(1):33-46.
[2] Joshua Z Drago,et al. Unlockingthe potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):327-344.
[3]Dan Lu, et al. Semi-mechanistic Multiple-Analyte Pharmacokinetic Model foran Antibody-Drug-Conjugate in Cynomolgus Monkeys.Pharm Res. 2015Jun;32(6):1907-19.
联系我们:
电话: +86 (21) 5859-1500(总机)













