



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近年来全球生物药市场增长迅速,其中主要产品包括重组胰岛素,人生长激素(HGH)和各种单克隆抗体(单抗mAbs)等。随着许多畅销的生物药专利逐渐到期、降低医疗成本压力的需求、以及新药研发日益增加的难度,生物仿制药市场显示出强劲的发展潜力。生物仿制药带来的机 会及发展趋势也成为医药界关注的焦点。同时,许多国家也正逐步完善生物仿制药的审批政策,帮助生物仿制药市场迎向快速发展的新时期。
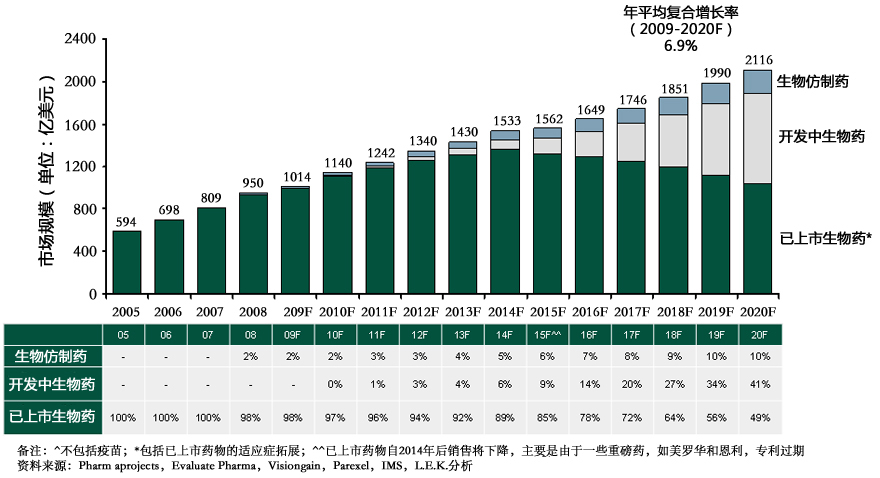
2005-2020年生物仿制药、开发中生物药、已上市生物药发展预测
目前中国生物药市场大约占整个中国药品市场的20-30%,增速很快并且市场份额将会持续增长。已上市产品基本上是生物仿制药,原研产品较少规模也相对较小,多为有特定市场的专科用药譬如肿瘤药。原研单抗药物厂家,主要为外资主导,正持续扩展铺货渠道增加市场占有率。发展初期可能注重于大城市大医院,但现在逐渐开始覆盖到其它重要省会和中心城市。在中长期的规划中,预计未来二三线城市会达到一线城市覆盖率水平。即使是传统观念认为价格较贵的生物药,未来也会有很好的发展空间。
目前国内生物制药公司主要提供生物仿制药概念的产品,一般是市场上比较成熟的药。新药在国内市场大部分仍在快速发展阶段,虽然大多为外资主导,国内厂商也不乏发展机会。例如中国的胰岛素市场规模非常大,有些国内厂家尝试进入,比如通化东宝,但整体规模目前都很小。未来预计会有更多的国内厂家尝试进入这些像是胰岛 素及单抗类产品相对较高端的市场。
国内生物制药公司想做单抗的公司非常多,主要分为两类:第一类包括中信国健,江苏泰康,百泰生物等,都是海归回国后吸收小规模人群组建技术公司。这些公司大多处于较早的产品技术研发阶段。第二类是比较传统的生物医药公司,比如沈阳三生,一般利 用现有的生物行业技术经验进入单抗领域。
中国的单抗市场目前主要分为肿瘤和风湿免疫,抗排异市场相对小很多。在单抗市场中,其中有9个进口的原研单抗。仿制药方面,已上市产品包括中信国健的益赛普,上海赛金的强克和百泰生物的泰欣生。
相对单抗来说,像EPO之类的第一代生物药,虽然普及率较高,但是市场空间或者发展潜力并不及单抗,因为市场渗透率已较高且竞争非常激烈,若没足够优势,再追加投入并不值得。
对于国内的生物仿制药企业,还存在着产品定价的问题。以中国EPO市场为例,进口产品Kirin的利血宝价格为国产仿制药的4倍,同时拥有较高的市场份额。国内产品只能采取价低价竞争,造成整个市场竞争激烈,利润空间小。除了三生之外,其他国内企业的份额大多很小。由此可见,今后中国企业做仿制单抗,如何在价格方面有所突破且避免恶性竞争将是一个必须要考虑的问题。
相对化学仿制药,生物仿制药的注册更加复杂并且是进入市场的主要关键。根据中国药品注册法规,除了正常申请临床试验批件和生产/进口批件的流程,化学药的仿药的临床试验仅需要完成生物等效性实验。但是对于生物仿制药,按照现行的规定则需按照新药注册且必须进行完整的临床试验。虽然某些情形下可以跳过第I、II期试验,但第III期临床试验是必须要完成的。相应地,生物仿制药的注册时间和经济成本都会增加,譬如如果临床试验观察终点和指标不同,成本也会不 同。
目前国内很多大药厂都在开发治疗风湿免疫/肿瘤的单抗药物。此类药物通常需要进行大样本量的第III期临床试验,仅试验本身一般就要耗时两三年,如果以总生存期为观察终点,试验时间和成本还将更高。同时从对临床试验的要求趋势来看,不管是医生(医院的道德委员会)和SFDA,今后对于入组临床试验的病人可能会要求选择目前市面上公认相对好的治疗方法,而不是随便取一个简单的治疗方案作对照,因此未来临床试验的成本 有大幅增加的趋势。
举例来说,中信国健在2001年做益赛普 (Etanercept) 临床试验的时候,由于原研药在国内还没有上市,所以只需与普通的抗风湿药物(DMARDs)做对比即有可能获得SFDA批准。但如果四五年后有其它公司要 做类似的新仿制药,则有可能被SFDA要求与依那西普(Etanercept)原研药(恩利Enbrel)做对照试验,以证明在研产品有和依那西普(Etanercept)有相似的疗效。如果这样,根据目前对于临床试验例数的要求,实验组需要有300例病人(不考虑病人脱落的情形),同时开发新药的公司必须免费提供对照组约 100-150例病人6个月的恩利,试验成本将大大高于以往只供应普通抗风湿药的费用。
由此可见,生物仿制药在本身研发难度 之外,其注册耗时长、临床试验成本高的特点也将成为另一种形式的壁垒。一些小公司可能觉得做化学仿制药很容易,但是做生物仿制药这一块将会遇到很大的资金 壁垒。即使对有雄厚研发实力的公司,可能也还需借助社会资本和金融资本来加速产品开发。
目前中国尚无区分生物原研药和仿制药的注册相关规定,所有生物药都作为新药进行审批。虽然还没有出台注册相关规定,第III期临床试验都将是必须的。这是因为对于原研药厂家来讲,制造生物药的过程和步骤非常重要,不仅考虑身体吸收程度的药代动力学(PK)方面的比较。由于生物仿制药实际上并不是真正完全跟生物原研药一样而只是在某些性质上相似,其有效性和安全性需要更仔细的研究及验证。举例来说,在欧洲,一个生物药厂换址,其产品都可能发生变化并需要严格的监管,甚至有可能被要求重新进行临床试验。因此未来生物仿制药不做III期试验就注册的可能性很低,但III期临床的规模和试验方式或有讨论空间。
除了临床实验的相关规定,目前欧洲的注册规定允许如果一个药有多个不同适应症,只需做一个适应症的临床试验,而其他适应症只需要做生物等效性实验。因此通常节省一个生物仿制药开发费用的方式之一是选择其市场最大的或最容易证明的适应症做临床试验,再扩展适应症。值得注意的是,考虑到每一个生物药都有不同的特性,在欧洲大部分生物药的试验要求都会根据每个案例的不同而有所变化。注册规定一般只提供基本框架,更多细节是通过与政府监管部门的讨论制定出来。对于用于治疗癌症的生物仿制药,由于治疗周期短,与政府讨论空间也较多。
随著各国生物仿制药的审批政策的出台,这些新的政策对于中国有很高的参考价值。根据生物谷(Bioon.com)的报导,国家食品药品监督管理局(SFDA)注册司生物制品处副处长常卫红在上海召开的2012中国抗体药物研发与产业化国际峰会暨项目合作洽谈会上表示,生物仿制药指南制定的前期工作正在规划中。生物仿制药指南准备工作將包含调研、起草、实施的三个步骤。其中调研这部分工作已经开始,包括政策、质量控制、临床前研究及临床研究。指南内容将会汇集包 括科学家、研究者、国内外企业家等组成的顾问团队所提供的意见。对照品设定、技术问题、相似度的审查难度及效益考虑等都将是指南需要研究的问题。
目前国内对于生物的规划有很多,例如发改委的生物产业规划中覆盖面包括医药工业,生物医药,生物产业等。“十二五”生物医药产业规划中单克隆抗体药物研究也 被列入国家重点项目。未来几年随著产业规划启动,中央财政扶持资金四百个亿的也将陆续投入。工信部也从生物科技角度制定了发展规划,内容包含很广,从诊断 到农业技术都有涵盖。但是工信部的规划在内容和目标上并没有特别针对生物药,主要讨论提高产业升级。比如说政府希望未来一类新药达到25个,并没有说明其 中化学与生物药的比例。
此外,许多生物企业表示政府在逐渐加大对产品研发的支持。其中可能的趋势是从研究机构牵头转为企业牵头,先由企业发起,再加入大学等研究机构。因为研究机构牵头往往没有可商业化的成果,而企业牵头有助于研究成果的商业转化。
地 方政府对于生物制药产业也提供很多优惠政策,包括税收和财政上的支持,或者从更直接的药物定价及医保的影响。如中信国健的益赛普,在上海就有住院病人的补 贴政策,虽然这个补贴在申请过程中遇到了很多困难:上海政府认为单抗国内领头企业及地方企业应该享有优惠政策;同时却也需要顾虑医保成本承担太多,最后仅 允许在住院病人这里医保,虽然实际情况是益赛普多用于门诊病人,而少用于住院病人。
对于国内的大型药企,如何建立内部系统流程来增加新生物药产品非常重要。其中一种可能的途径是与海归人士合作成立公司。比如复星在美国有投资一家小的公司专门做前期研发。这家小的公司刚开始的模式就是海归人士做单抗的研究,回国后与复星投资成立公司,其中复星投资占80%股份。
海外并购有成熟技术的国外企业也有可能加速开发单抗的进程。一种方式是投资国外的公司,帮助其技术团队增长,再利用他们资源在中国发展。例如药明康德就在美国并购了专门做生物这一方面的生物医药研发外包公司(CRO),再把美国技术引进到中国。
在当前的经济情况下,并购美国公司不一定比中国公司贵。因为投资者预期中国市场增长率高,中国公司的市盈率倍数非常高,而美国现在给生物企业的估值相对中国来说较低。在2007年金融危机之后,美国有很多有好技术但是缺乏资金的公司面对资金短缺的压力且没办法往下一步发展。中国企业若有机会像复星一样投资这些企业可能会是不错的合作机会。若能并购到的企业有较为成熟的生物药且市场规模较大,更可以直接引入中国做新药。
通常在美国欧洲现行的中小型公司模式是将生物技术直接外包给合同生产外包厂家(CMO),发展到一定阶段再自建或委托生产。把并购的公司所有营运移到中国不一定是个很好的模式,将研发与技术留在美国或欧洲而把生产迁到中国或许是一个更好的选择。
生物仿制药在中国有很大的市场发展潜力。未来几年随着政府在生物医药产业规划的重点开展,生物制品研发的加速和医药内需的扩大,市场预计将以非常快速的速度增长。目前主要面临技术和监管方面的难题及不确定性。国内生物仿制药未来发展的机遇将主要取决于这两方面的发展。
在技术层面,国内药企生物药品的研发、临床研究及制药等的技术水平跟生产工艺等都难以与国外相竞争。生物仿制药在生产复杂性及仿制难度等方面都比化学仿制药高出许多,需要一个公司具备扎实的药品研发知识、经验和技术。这些条件对希望进入生物仿制药市场的公司提出了更高的要求。不过国内的生物仿制药企业正积极 地投资研发团队及设备,并期望能缩小与国外厂家的差距。
在监管方面,生物仿制药的监管法规包括注册管理、标准化与质量控制等都尚未明确。由于生物药的验证比化学药更加复杂,制定监管政策的难度也相对提高。此外目前所有生物药都按照新药的流程进行审批,导致了生物仿制药高昂的研 发成本和漫长的研发周期。随着未来生物仿制药指南的出台,市场的不确定性将降低,较新药简略的监管法规也将大力推动生物仿制药的发展。
目前中国生物药市场大多是仿制药及缺乏技术含量并较普遍的药品,单抗、疫苗和重组蛋白领域等较高端的生物药市场主要为高价的原研药,且品种较少。随着众多原研药专利到期、高端的生物药使用率性提高和生物仿制药简略申请政策出台,如果能在技术和监管方面提供良好的条件,生物仿制药有机会成为未来医药业的发展亮 点。
越来越多的中国医药公司开始进入到生物仿制药领域尤其是单抗仿制药领域,由于在该领域所需要的巨额投资,L.E.K.咨询建议每个希望进入的国内医药公司在开始投入之前先衡量一下自己的实际情况和发展规划:
? 公司是否已经有生物制药业务,不管是自然提取还是重组技术?如果没有,公司认为自己能够在这个新兴领域取得成功有哪些支持?
? 公司如何能够快速建设自己的生物仿制药能力?公司是倾向于自主技术开发还是通过技术转让(通过技术收购或者其他合作形式)亦或是收购的形式?
? 与众多潜在的内资和外资生物仿制药的竞争对手相比,公司有哪些特别之处?公司是否在自己所规划的未来生物仿制药所在的治疗领域,如肿瘤或者风湿科,拥有有竞争力的产品和业务基础?
? 公司是只专注于中国国内市场,还是国际市场也是未来的发展方向?
? 如果国际市场也是未来份额发展计划之一,那么打算在什么时间点拓展,拓展到哪些地区?公司如何预先规划以在亚洲、拉丁美洲、欧洲和美国市场获得收益?
未雨绸缪,规划一个清晰的战略对于所有的公司和业务永远是一个正确的选择。对于生物仿制药业务而言尤其如此,因为就一个单抗仿制药的开发、注册、生产和营销 的总成本至少要上亿元。如果中国医药企业只是重现九十年代大举进入重组蛋白生产的“淘金潮”,这对于中国生物医药产业的声誉和发展都是无利甚至有害的。首 先注重取得优质的、稳定的技术,高规格的质量顺准以及临床上优异的结果,那么整个中国生物仿制药产业在未来将获得更大、更长远的成功。
 相关新闻
相关新闻