



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com





2023年IASLC世界肺癌大会(WCLC)将于9月9~12日举行。作为肺癌领域全球规模最大的学术会议之一,大会致力于探讨肺癌及其他胸部恶性肿瘤的前沿诊疗进展,纳入多项重磅研究。
8月16日,2023WCLC已在大会官方网站披露可公布的摘要。美迪西Marketing梳理了有关“魔法子弹”ADC药物的相关报告,围绕HER3、TROP-2等热门靶点的多项研究数据将于大会公布。

摘要号:OA05.03
标题:Patritumab Deruxtecan (HER3-DXd) in EGFR-Mutated NSCLC Following EGFR-TKI and Platinum-Based Chemotherapy: HERTHENA-Lung01
讲者:H.A. Yu| Department of Medicine, Medical Oncology, Memorial Sloan Kettering Cancer Center, New York/NY/USA
口头报告时间:September 10, 2023 at 3:02 PM UTC +8,10m
HER3-DXd(Patritumab Deruxtecan,U3-1402)是一种新型的HER3靶向ADC药物,由一个全人源化HER3单抗,通过稳定的四肽可裂解连接子与拓扑异构酶I抑制剂的有效载荷相连。
这项开放标签试验随机纳入了既往接受过EGRF-TKI和铂类化疗的晚期EGRF突变NSCLC患者,并分别接受两种剂量方案:推荐剂量组(5.6mg/kg IV Q3W)或剂量递增组(3.2-4.8-6.4 mg/kg)。
推荐剂量组入组已达目标,而基于I期数据的效益-风险评估,剂量递增组的入组提前停止。
本试验的主要终点是根据 RECIST 1.1 版通过盲法独立中心审查 (BICR)确认的客观缓解率(ORR)。
5.6 mg/kg组中,共225例患者接受了HER3-DXd给药。截至2022年11月21日,中位试验持续时间为13.1个月,范围:9.0-21.6个月;中位治疗持续时间为 5.5 个月,范围:0.7-18.2个月。
经BICR评估:cORR为28.4%;中位DOR为6.0个月;中位PFS为5.5个月;中位OS(初步)为11.9个月。
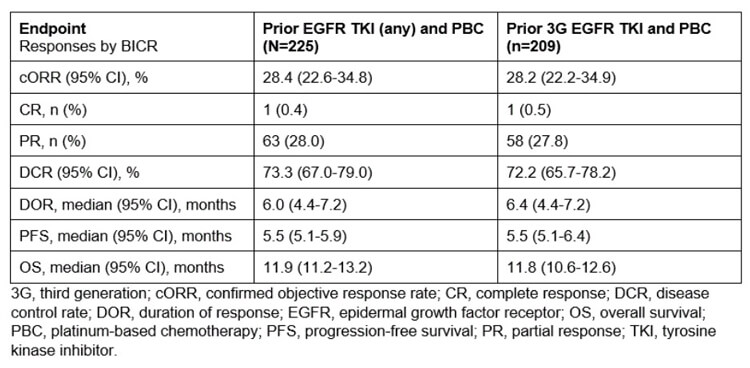
数据显示,既往接受过奥希替尼治疗的患者临床获益结果相似。此外,在不同HER3表达和多种EGFR-TKI 耐药机制中均观察到临床活性。
在基线时未经放射治疗的脑转移患者(n=30)中,经BICR确认的CNS ORR为36.7%(95% CI,19.9%-56.1%;CR: 10/30,PR: 1/30)。
与之前的观察结果一致,不良事件(AEs)可控且可耐受:10例患者(4.4%)因药物相关AEs停药,4例患者(1.8%)死亡;45.3%的患者出现≥3级药物相关 AEs;12例患者(5.3%)出现独立判定的药物相关间质性肺病(1/2级,n=9;3级,n=2;5级,n=1)。
HER3-DXd的疗效具有临床意义,且该研究首次报道了在中枢神经系统(CNS)的疗效。HER3-DXd很可能成为EGFR-TKI治疗后进展或不同耐药突变患者的前景疗法。目前,针对经EGFR-TKI治疗后进展的EGFR突变NSCLC患者的III期试验HERTHENA-Lung02(ClinicalTrials.gov, NCT05338970)正在进行中。
摘要号:OA05.04
标题:Sacituzumab Govitecan + Pembrolizumab in 1L Metastatic Non-Small Cell Lung Cancer: Preliminary Results of the EVOKE-02 Study
讲者:B.C. Cho| Yonsei Cancer Center, Yonsei University College of Medicine, Seoul/KR
口头报告时间:September 10, 2023 at 3:12 PM UTC +8,10m
以程序性死亡受体1(PD-[L]1)抑制剂为基础的治疗方案是转移性非小细胞肺癌(mNSCLC)的一线标准治疗方案,本次研究围绕改善疗效的联合治疗方案展开。
Sacituzumab govitecan(SG)是一种靶向TROP-2 的ADC药物,其临床显示活性且安全性可控。这项正在进行的全球开放标签、多队列、2 期 EVOKE-02 研究(NCT05186974)评估了SG + Pembrolizumab(Pembro)±铂类药物作为 mNSCLC 一线治疗效果。本次报告将解读两组不同PD-L1肿瘤比例评分(TPS)区间的患者治疗的初步结果。
本试验终点包括客观反应率(ORR;根据 RECIST v1.1)、无进展生存期、反应持续时间、疾病控制率、总生存期和安全性。
试验队列分为:队列A,TPS≥50%;队列B,TPS<50%。试验以21天为1周期,患者分别在第1天和第8天接受SG 10 mg/kg治疗,并在第1天接受Pembro 200 mg治疗。
截至2023年1月13日,共44名患者(队列A:16例;队列B:28例)入组并接受治疗。
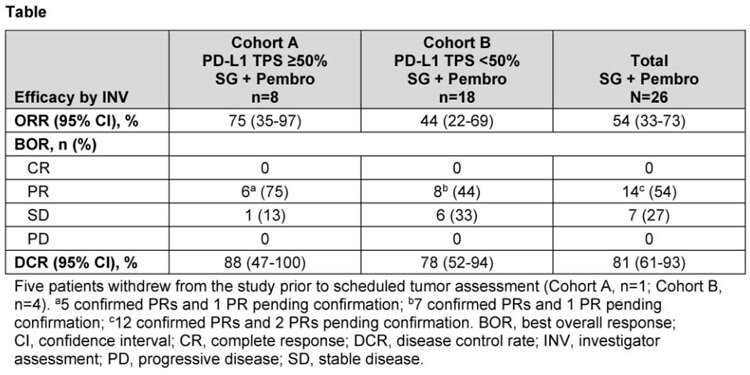
在疗效有效的患者*(队列A:8例;队列B:18例)中,经评估,队列A的ORR为75%(5例证实PR,1例有待证实的PR),队列B的ORR为44%(7例证实PR,1例有待证实的PR)。
注*:疗效结果报告随访时间≥13.0周的疗效有价值的患者)
在安全性有效的患者**(44 例)中,突发不良事件(TEAEs)发生率为 96%(3/4级,52%)。
最常见的任意级别TEAE为腹泻(50%)、贫血(41%)、虚弱(36%)和中性粒细胞减少(32%)。导致停药的TEAE发生率为7%。此外,有3例(7%)患者因 TEAE死亡,只有1例(2%)被认为与研究治疗有关。
注**:安全性结果报告接受了≥1个剂量研究治疗的安全性有价值的患者
在本次试验中,SG + Pembro的联合治疗方案在mNSCLC患者的一线治疗中显示了鼓舞人心的早期疗效,安全性可控,且与每种药物的已知安全性一致。随后,研究团队将陆续公布对更多患者和更长时间的随访结果。
摘要号:OA05.05
标题:Ifinatamab Deruxtecan (I-DXd; DS-7300) in Patients with Refractory SCLC: A Subgroup Analysis of a Phase 1/2 Study
讲者:M. Johnson| Sarah Cannon Research Institute, Nashville/TN/USA
口头报告时间:September 10, 2023 at 3:22 PM UTC +8,10m
B7同源物3(B7-H3)是一种I型跨膜蛋白,65%的小细胞肺癌(SCLC)患者体内有中度到高度的B7-H3过表达。
I-DXd 是一种新型B7-H3靶向的ADC药物,它利用了经过临床验证的Deruxtecan (DXd) 技术,结合了血液循环稳定性的连接子和强效拓扑异构酶 I 抑制剂有效载荷。
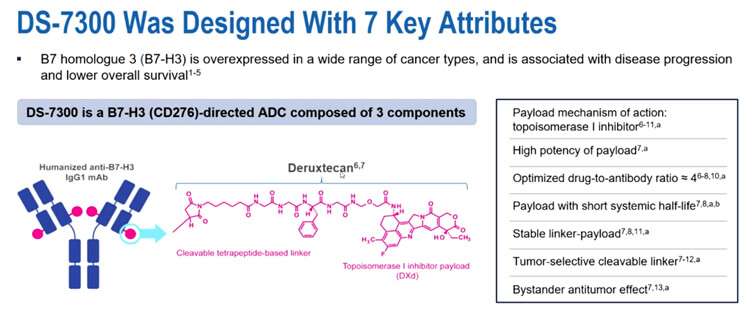
在ESMO 2022,研究团队曾发布了针对经多线治疗的晚期实体瘤患者的1/2期试验相关结果。本次报告将围绕接受I-DXd治疗的SCLC患者进行的中位11.7个月随访展开分析,包括反应率、无进展生存期 (PFS) 和总生存期 (OS) ,并基于B7-H3表达的疗效分析。
而亚组分析主要针对1/2期试验第一部分的SCLC亚组,试验包括未经B7-H3表达筛选的经多线治疗晚期实体瘤患者。疗效和安全性分析包括接受4.8至16.0毫克/千克剂量I-DXd治疗的SCLC患者。
截至2023年1月31日,21例SCLC 患者的安全性、反应、PFS 和 OS 均可接受评估。目前还有2例患者仍在接受治疗。患者既往接受治疗的中位数为2次(范围:1-9次);大多数曾接受含铂化疗和免疫疗法。
安全性与之前的报告一致。
截至2022年6月30日,16例患者可进行B7-H3分析评估。在所有可评估的参与者中,B7-H3的表达水平为中度至高度。研究团队未观察到最佳缓解或肿瘤缩小与B7-H3阳性或强度之间的关联趋势,仍需要更大的样本量来证实这些结果。
B7-H3相关性的最新分析结果将在大会上公布。
I-DXd在经多线治疗SCLC患者中表现出了强大而持久的疗效。同时,它的耐受性和毒性也在可控范围内。目前,针对二线或三线广泛期SCLC患者的II期试验(NCT05280470)正在进行中。
摘要号:OA05.06
标题:Datopotamab Deruxtecan (Dato-DXd) + Durvalumab ± Carboplatin in Advanced/mNSCLC: Initial Results from Phase 1b TROPION-Lung04
讲者:K.P. Papadopoulos| START San Antonio, San Antonio/TX/USA
口头报告时间:September 10, 2023 at 3:32 PM UTC +8,10m
Dato-DXd是一种靶向TROP-2的ADC药物,其在单药治疗和与抗PD-1±铂类化疗的联合治疗中均显示出令人鼓舞的早期疗效和安全性。
TROPION-Lung04(NCT04612751)是一项针对晚期/转移性NSCLC的1b期、多中心、开放标签、剂量递增/确认和扩展研究。本次报告将对该试验的1-4队列的首批数据进行中期分析。患者接受Dato-DXd(4 mg/kg,队列1/3;6 mg/kg,队列2/4)联合度伐利尤单抗(1120 mg,所有队列)+最多4个周期的卡铂(AUC 5,队列3/4),Q3W,直至疾病进展(RECIST v1.1)或发生毒性不耐受。队列1中的患者和队列2中的1例患者接受过≥1次含铂化疗方案和抗PD-1/PD-L1治疗。
在剂量递增/确认试验中,队列1~4采用改良毒性概率间隔-2(mTPI-2)设计,由3-6名患者依次进行。
该试验的主要终点为药物安全性/耐受性,次要终点则包括研究者评估的客观反应率(ORR)和疾病控制率(DCR) (RECIST v1.1)。
截至2023年3月6日,试验内共38名患者疗效可评估。其中,队列4中两名患者报告了DLT(3级[G3]发热性中性粒细胞减少症1例;G3 斑丘疹和口腔炎1例,并导致第2周期延迟2周以上)。
在队列2/4中,患者肿瘤细胞的PD-L1表达情况如下:
<1%:31.6%/42.9%、1-49%:31.6%/21.4%,和≥50%:36.8%/35.7%。
队列2/4患者治疗周期的中位数为8.0周(范围:1-16)/8.5周(范围:2-16);31.6%/50.0%的患者在DCO时仍在接受治疗。
队列2的一线治疗患者(14 人)中,ORR为50.0%(7例确诊PR),DCR:92.9%;
队列4的一线治疗患者(13 人)中,ORR为76.9%(9例确诊PR,1例在DCO后确诊PR),DCR:92.3%。
数据显示,所有PD-L1表达水平的患者均出现了应答,且三联疗法的应答率普遍优于双联疗法。
100%/42.1%(队列2)和100%/71.4%(队列4)的患者发生了治疗突发不良事件(TEAEs;全等级/G≥3)。
最常见的TEAEs如下:队列2中的便秘(57.9%/0)、口腔炎(52.6%/10.5%)、脱发(52.6%/0)、恶心(42.1%/0);队列 4 中的口腔炎(64.3%/7.1%)、脱发(57.1%/0)、恶心(57.1%/0)、贫血(50.0%/35.7%)。在队列 2/4 中,分别有 21.1%/21.4%和 15.8%/35.7%的患者出现导致治疗中止和 Dato-DXd 剂量减少的 TEAEs。无治疗相关死亡。
Dato-DXd联合度伐利尤单抗±卡铂在晚期/转移性NSCLC患者治疗中,表现出了安全性可控及优秀的抗肿瘤活性。
ADC药物已在乳腺癌等实体瘤治疗领域中逐步突破“壁垒”。期待即将在2023WCLC披露的研究数据,将“魔力子弹”攻克肺癌及其难治亚型的进展推向下一浪,实现更多肺癌患者获益。
美迪西在ADC的临床前一体化研究方案制定中与客户深入交流,科研骨干将每一个案例的特点与多年实战经验和技术积累相结合,谨慎地将优质实验方案与结果提交到客户手上。美迪西可以为客户提供ADC Payloads合成、ADC药物偶联、ADC药效学评价、ADC药代动力学评价和ADC安全性评价等服务。
截至2022年末,美迪西已成功助力12个ADC药物获批临床,并有10多个ADC项目在研。
2023WCLC官网公布报告摘要,链接:https://cattendee.abstractsonline.com/meeting/10925/Session/90
如您对本期话题有进一步想要了解的内容,或您希望美迪西Marketing讨论更多行业资讯,欢迎关注“美迪西Marketing”公众号,给我们互动。期待您的"美"思妙想~
 相关新闻
相关新闻