



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




生物利用度:是指药物活性成分从制剂释放吸收进入全身循环的程度和速度。一般分为绝对生物利用度和相对生物利用度。绝对生物利用度是以静脉制剂(通常认为静脉制剂生物利用度为100%)为参比制剂获得的药物活性成分吸收进入体内循环的相对量;相对生物利用度则是以其他非静脉途径给药的制剂(如片剂和口服溶液)为参比制剂获得的药物活性成分吸收进入体循环的相对量。
(1)自制产品与原研品的质量全面对比
● 四条溶出曲线的比对
● 稳定性的比对:有关物质、含量、聚合物、异构体等
● 影响因素:溶出度、有关物质、含量、聚合物、异构体等
● 长期和加速条件
(2)处方工艺改进
● 处方优化
● 工艺改进
邮箱:marketing@medicilon.com.cn
电话:02158591500
以上是关于仿制药一致性评价的服务内容,了解详情请点击一致性评价。
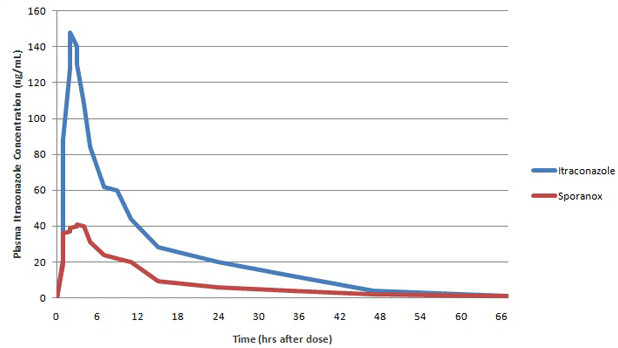
生物利用度(Bioavailability BA)是反映药物活性成分吸收进入体内的程度和速度的指标。过去出现的一些由于制剂生物利用度不同而导致的不良事件,使人们认识到确有必要对制剂中活性成分生物利用度的一致性或可重现性进行验证,尤其是在含有相同活性成分的仿制产品要替代它的原创制剂进入临床使用的时候。鉴于药物浓度和治疗效果相关,假设在同一受试者,相同的血药浓度-时间曲线意味着在作用部位能达到相同的药物浓度,并产生相同的疗效,那么就可以药代动力学参数作为替代的终点指标来建立等效性,即生物等效性(Bioequivalence BE)。
BA和BE研究已经成为评价制剂质量的重要手段。本指导原则将重点阐述BA和BE研究的相关概念,应用范围和BA和BE研究的设计、操作和评价等。
如果含有相同活性物质的两种药品药剂学等效或药剂学可替代,并且它们在相同摩尔剂量下给药后,生物利用度(速度和程度)落在预定的可接受限度内,则被认为生物等效。设置这些限度以保证不同制剂中药物的体内行为相当,即两种制剂具有相似的安全性和有效性。
BA(生物利用度)和BE(生物等效性)均是评价制剂质量的重要指标,BA强调反映药物活性成分到达体内循环的相对量和速度,是新药研究过程中选择合适给药途径和确定用药方案(如给药剂量和给药间隔)的重要依据之一。BE则重点在于以预先确定的等效标准和限度进行的比较,是保证含同一药物活性成分的不同制剂体内行为一致性的依据,是判断后研发产品是否可替换已上市药品使用的依据。
BA 和 BE 研究在药品研发的不同阶段有不同作用:
在新药研究阶段,为了确定新药处方、工艺合理性,通常需要比较改变上述因素后制剂是否能达到预期的生物利用度;开发了新剂型,要对拟上市剂型进行生物利用度研究以确定剂型的合理性,通过与原剂型比较的BA研究来确定新剂型的给药剂量,也可通过BE研究来证实新剂型与原剂型是否等效;在临床试验过程中,可通过BE研究来验证同一药物的不同时期产品的前后一致性,如:早期和晚期的临床试验用药品,临床试验用药品(尤其是用于确定剂量的试验药)和拟上市药品等。
在仿制生产已有国家标准药品时,可通过BE研究来证明仿制产品与原创药是否具有生物等效性,是否可与原创药替换使用。药品批准上市后,如处方组成成分、比例以及工艺等出现一定程度的变更时,研究者需要根据产品变化的程度来确定是否进行BE研究,以考察变更后和变更前产品是否具有生物等效性。以提高生物利用度为目的研发的新制剂,需要进行BA研究,了解变更前后生物利用度的变化。