



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




播种有时、成长有时、收获有时。对于生物医药行业来说,亦如此。在持续多年的政策与资本支持的滋润下,中国生物医药行业创新能力量汲取到了成长养分,在抗体、ADC、PROTAC、CGT疗法等新兴领域厚积薄发,与海外药企的代际差距逐渐消弭,有了全球顶尖制药企业平坐掰手腕的力量。这股力量驱动创新药命运的齿轮,从悄然转动到加速狂飙!
时下创新药研发深陷同质化内卷,出海无疑成为创新药企抓住机遇、摆脱困境的必选项。中国创新药发展迎来空前大爆发,出海潮来势汹汹,不仅接连成功闯关FDA,对外授权合作规模也再创新高。
造船出海
中美双报已成大势所趋
众所周知,美国是全球最大的医药市场,FDA也拥有全球最完善、最严格的药品审评体系。获得FDA的批准,意味着这款药大概率能顺利通过全球其他40多个地区的审批,基本获得了全球医药市场的准入门票。随着中国加入ICH,中美双报正逐渐成为中国药企全球化布局与发展的一种新趋势。越来越多企业目光逐渐转向出海,越来越多企业开展中美双报,开启造船出海之旅。
据统计,2023年FDA批准的新药总数达到66款(其中包括55个药物和11个疫苗、生物制剂),远超2022年,创下五年新高。同时,获批新药适应症呈现出百花齐放趋势,其中罕见病和肿瘤仍是重点领域,取得令人瞩目的成绩。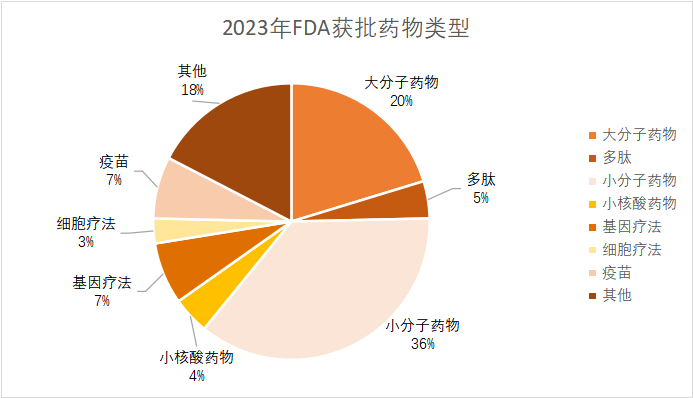
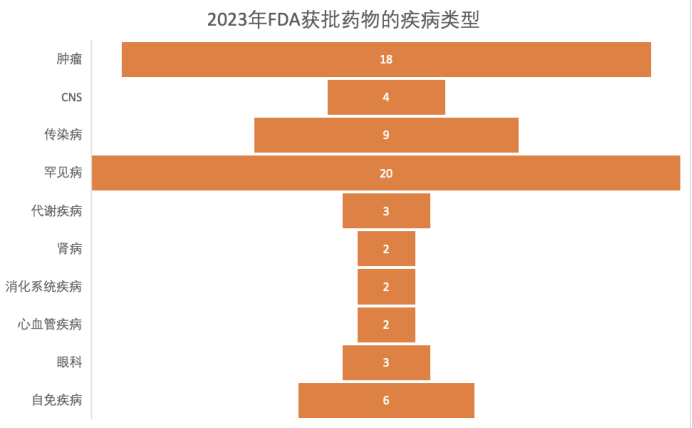
图片来源于 动脉网
作为中国较早提供整套同时符合中国GLP和美国GLP标准的新药临床研究申报的CRO公司之一,美迪西有幸参与了宇耀生物和标新生物的临床前研发。加速了其研发进程。
美迪西现拥有2.9万㎡实验室获得NMPA药物GLP实验室资质,符合美国FDA, 澳洲TGA,欧盟 EMEA 的GLP实验室标准,拥有完整的化学发现,药学研究全程的标准服务。据不完全统计,仅在2023年,美迪西参与研发完成新药及仿制药项目已有总共约90件通过中国NMPA及美国FDA的审批进入临床试验。美迪西注册事务服务平台深入了解中国、美国、澳洲和欧盟等国家和地区的注册法规政策以及其对药物的技术要求,能为国内外的客户提供药品开发和注册策略咨询以及基于NMPA和FDA的新药临床试验(IND),仿制药上市申请(ANDA)申报资料的编制报批服务。同时拥有专业的IND、ANDA技术研究团队,可提供一站式的临床前研究、全程项目管理以及注册服务,已积累了丰富的中美双报项目实战经验。
借船出海
License out开启狂飙新时代
新药IND申请获美国FDA批准是获得创新药出海的入场券,要想真正登上国际舞台,药企还要应对在海外开展临床翻倍的成本、陌生的商业化环境等重重挑战。面对再大的海外“蛋糕”,有些药企也只能望洋兴叹。而License out交易模式,不仅可以快速回笼资金、补充研发,还可以借助海外药企的各种资源,实现优势互补、降低新药研发风险,快速进入国际市场、获得丰厚现金流。
因此,门槛更低、风险更小、更成熟的License-out模式成为中国创新药企业的替代之选。
风云际会,与造船一样,借船出海同样迎来发展黄金期。据不完全统计,截至2023年12月21日,2023年国内共发生了近70笔创新药License-out交易,已披露交易总金额超350亿美元。这一数据已经远超去年,据康橙投资数据,2022年,中国创新药License-out交易发生了44起,披露的交易金额约275.50亿美元。
截至目前,美迪西已成功助力多款创新药物成功出海,也持续关注新兴医药企业的出海战略和商业化落地。推动加速合作伙伴的临床前开发,助力创新药企扩展全球化版图,美迪西使命必达。
打铁还需自身硬,无论是造船出海,还是借船出海,解决产品同质化、创新差异化、提高研发效率等问题,做真正的创新药才能打赢出海攻坚战,劈波斩浪直抵彼岸。
乘风出海任重道远
看美迪西如何助力创新药企扬帆出海?
产品:如何打造差异化竞争优势?
随着创新药企及管线越来越多,创新药靶点类似,很容易在拥挤、热门的赛道中获得一席之地。如何打造差异化竞争优势是核心问题。
美迪西依托智能靶点和AI虚拟药物发现平台,有着开发并验证针对不同靶点分析方法的丰富经验,能够有效根据需求分析靶点的表达水平、以及靶点可及性,为靶点的选择提供建设性意见。如在ADC领域,已助力完成针对Her2、Her3、Trop2、Claudin 18.2、CD33、Muc1、FR等靶点药物的开发;在KRAS、STAT3、GLP-1R等新兴靶向药等均有搭建一站式临床前研发服务平台,赋能药物在赛道上加速跑。
融资:如何突破新药研发资金瓶颈?
据动脉橙产业智库统计,2023年前三季度,中国共计发生128件融资事件,同比下降24%;融资额度上,为总额361.74亿元,同比下降54%。生物医药领域的投融资环境明显趋紧。融资是横在药物研发路上的难题。
为打造了一个全新的投融助力平台,为新药的研发、试验、上市等各个环节提供稳定的资金支持,美迪西院士创新药熟化中心与多家金融机构合作,搭建新药投融助力平台,旨在为新药研发提供资金支持。
研发:助力高质效推进药物研发进程
据毕马威的数据统计,对于药效不变的前提下,首次上市的药物市占率达约65%,其次约占25%,后来者市场占率较微乎其微。所以,出海是一场时间上的攻坚战,速度是非常重要的考量因素。
美迪西一家专业的生物医药临床前综合研发服务CRO,为全球的医药企业和科研机构提供全方位的符合国内及国际申报标准的一站式新药研发服务,服务涵盖医药临床前新药研究的全过程,主要包括药物发现、药学研究、临床前研究及IND申报。至2023年底,美迪西已为全球超2000家客户提供药物研发服务,参与研发完成的新药及仿制药项目已有420件IND获批临床。
交易:助力创新药阶段性成果交易
实现License out,需要非常严谨和完善的BD业务对接机制。根据媒体公开报道,不完全统计,2023年前三季度全球药企之间“退货”已达15例,其中国内药企出海遇阻案例已达8例。在浪潮下,“退货”事件提醒着我们不能盲目乐观。
为了助力新药研发阶段性成果的转化和交易,美迪西院士创新药熟化中心建立了公开、透明的新药研发交易平台,鼓励更多的科研人员投入到新药的研发中,助力科研成果得到更好的展现和回报。
好药无国界,就应去往更广袤的天地!成功造船出海或借船出海,无疑充分证明中国药企的创新研发能力得到了国际市场的认可。美迪西将通过不断完善一站式生物医药临床前研发服务平台,为创新药企业出海护航,助力更多的创新药叩开美国FDA大门,叩响生物医药国际舞台的大门!
美迪西助力 | 宇耀生物STAT3双磷酸化位点抑制剂YY201成功完成中美双报
美迪西助力 | 标新生物第二个分子胶管线GT929实现中美双报双批
美迪西助力 | 盛世泰科1类创新药物CGT-9475实现中美双报双批
美迪西助力 | 标新生物首个分子胶降解剂管线GT919新药临床研究申请获FDA批准
美迪西助力 | 全球独创,开悦生命针对RNA解旋酶的小分子新药获FDA临床实验许可(IND)
美迪西助力 | 国内首个CD19×CD3×CD28三特异性抗体获FDA默示许可
美迪西助力 | 璧辰医药ABM-1310获美国FDA孤儿药资格认证
美迪西助力 | 百明信康首创格雷夫斯症(Graves)新型特异性免疫疗法获FDA临床许可
美迪西助力 | 宝太生物首个自主研发新药BIOT-001 IND申请获FDA批准
美迪西助力 | 逻晟生物首款新药NB002 IND申请获FDA临床许可
 相关新闻
相关新闻