



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




STAT3是一种在多种组织中表达的信号分子,调控一系列与癌细胞生长、增殖、血管生成、转移、耐药性和免疫逃逸等有关的基因。因此,靶向 STAT3 信号通路已成为许多癌症的潜在治疗策略。美迪西可以为客户提供STAT3药物发现、药学研究(原料药工艺开发+制剂)、临床前研究服务(包括药效、药代、安评)以及IND申报等一站式服务。
信号转导和转录激活因子(signal transducer and activator of transcription, STAT)是一大类具有细胞质内信号转导和细胞核内转录激活双重作用的蛋白,广泛存在于哺乳动物细胞中,介导多种细胞内信号通路。尽管STAT家族成员高度同源,但功能却千差万别。
STAT3是一种在多种组织中表达的信号分子。STAT3可被多种因素激活,包括细胞因子、生长因子、神经内分泌因素、缺血缺氧刺激等。作为一种功能多样化的转录因子,STAT3能与大量的信号分子相互作用,并形成了多种细胞内外信号通路。
STAT3参与了细胞的增殖、存活、分化和血管生成等多种生物学过程。在正常细胞中,STAT3通过磷酸化瞬时激活,将质膜上的细胞因子和生长因子受体的转录信号传递到细胞核。研究表明,持续激活的STAT3对于多种癌症是必不可少的,比如乳腺癌和结直肠癌,这使得STAT3成为理想的药物靶点。然而,STAT3在大多数人类癌症中变得过度激活,通常与不良的临床预后有关。
STAT3通过信号转导和转录激活参与了生物体内复杂多样的生命活动,是当前的研究热点,其在肿瘤领域的研究已经取得阶段性的成果,STAT3作为多种肿瘤通路的汇合点,在肿瘤细胞中持续大量表达,能够促进肿瘤细胞增殖、抵抗细胞凋亡、介导原癌性炎症和抑制抗肿瘤免疫等,STAT3在一定程度上已经成为肿瘤治疗的重要分子靶点!
STAT家族由七个成员组成,即STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6。STAT3有两种具有不同功能的剪接亚型,STAT3α和STAT3β。STAT3α的结构域完整,STAT3β与STAT3α相比在C末端缺失55个氨基酸残基。STAT3β比STAT3α具有更好的特异性DNA结合活性。STAT3的主要作用是促进肿瘤生长和免疫抑制。编码STAT3的基因位于人类17号染色体上,该蛋白质由770个氨基酸组成,具有六个功能保守结构域:
❖ N末端结构域(NTD):促进STAT二聚体的形成,使其随后能够与转录因子结合;
❖ 螺旋卷曲结构域(CCD),用于向受体招募STAT3以及随后的磷酸化、二聚化和核转位;
❖ DNA结合结构域(DBD),用于识别和结合靶基因调控区域的DNA序列;
❖ 连接结构域(LD),将DBD连接到SH2域,确保DNA结构域的稳定性;
❖ SRC同源2结构域(SH2):最高度保守的STAT结构域,用于招募和激活STAT3分子,通过与相对亚基中的磷酸化酪氨酸残基相互作用来实现STAT3分子的二聚化;
❖ 转录激活结构域(TAD):通过磷酸化来促进其他转录激活因子的组装。
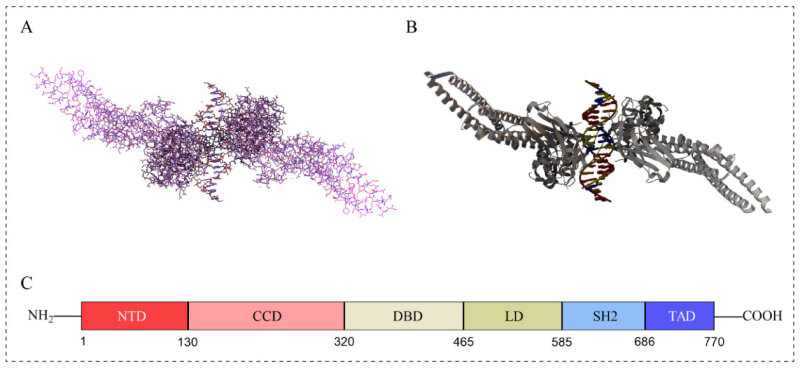
STAT3的结构示意图[1]
JAK/STAT通路是调节细胞功能最重要的信号通路之一,该通路中已鉴定出数十种细胞因子和生长因子,包括白细胞介素(IL)、干扰素和血管生成因子。IL-6是一种炎症介质,在肿瘤微环境(TME) 中,IL-6可由多种细胞产生,包括巨噬细胞、中性粒细胞、成纤维细胞和肿瘤细胞本身。IL-6可以直接引起癌细胞增殖,还可以促进TME中其他炎症因子的产生,并招募大量免疫细胞。因此,IL-6是慢性炎症和肿瘤进展的关键物质。响应IL-6刺激,JAK/STAT3通路被磷酸化,在人体内形成关键的IL-6/JAK/STAT3通路,参与类风湿关节炎、炎症性肠病及许多人类癌症的过程。目前,已鉴定出四个关键的JAK分子,即JAK1、JAK2、JAK3和TYK2。其中,JAK3仅在造血和淋巴系统的细胞中表达,而其余三种几乎在所有细胞中表达。JAK包含七个同源结构域 (JH1-7),并形成四个结构域:JH1、JH2、SH2 和 FERM。
经典的IL-6信号通路由IL-6与膜结合受体IL-6受体 α (IL-6Rα) 和gp130介导,形成IL-6/IL-6R/gp130复合物,从而导致细胞内JAK激活。JAK蛋白与gp130的胞内结构域结合,导致gp130的酪氨酸残基磷酸化,形成STAT3结合位点。STAT3识别并与磷酸酪氨酸对接位点结合后,附着的具有活性的JAK酶导致STAT3中705位酪氨酸的磷酸化,这促使两个磷酸化的STAT3单体发生二聚化,并且进入细胞核,从而激活多种下游基因的转录。
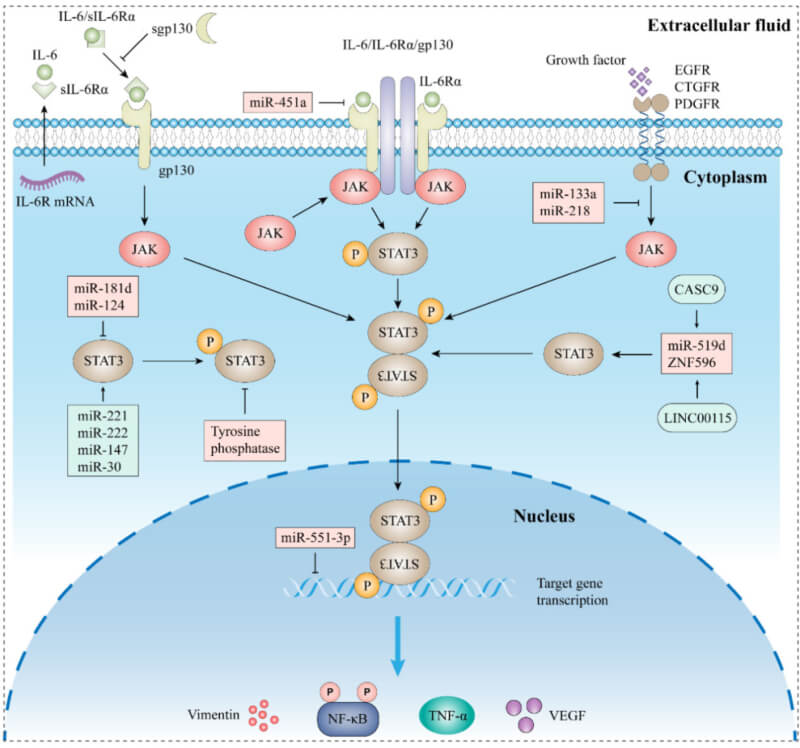
IL-6/JAK/STAT3 signaling pathway[1]
鉴于STAT3在肿瘤发生发展中的关键作用,以STAT3为靶点进行药物开发已成为近二十年来主要的药物研究热点之一。目前已有许多化合物被报道具有STAT3相关通路抑制活性,许多药物已进入临床。下图显示了目前处于临床研究阶段的部分STAT3抑制剂,适应症包括肝癌、结直肠癌、黑色素瘤、白血病等多种疾病。
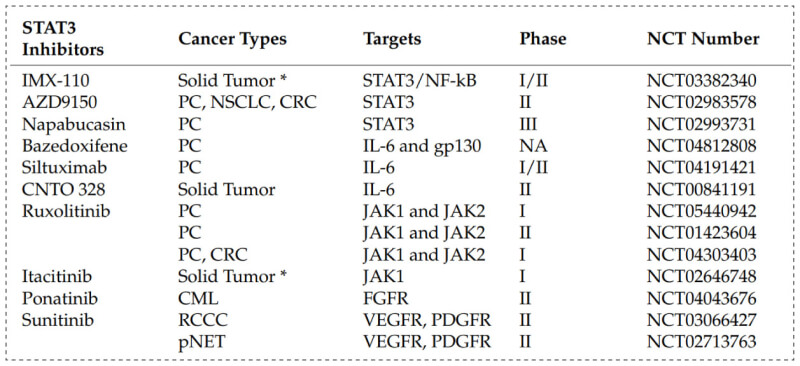
STAT3 inhibitors in clinical trials[1]
由于肿瘤发生的复杂机制,通过药物联用同时抑制多个靶点是一种重要的抗癌策略。目前,以化疗为代表的传统方法仍然是治疗癌症的主要选择。然而大多数化疗药物仅作用于一个靶点,治疗一段时间后还可能会产生耐药性。调节两个或多个相关靶点的药物可能会在癌症治疗中产生协同治疗效果。因此,越来越多的抑制两个特定靶点的疗法在临床研究中取得了成功。
组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类与肿瘤发生密切相关的表观遗传酶,在许多重要的细胞过程中起着重要的调节作用,包括细胞生长、细胞分化和细胞凋亡。多种HDAC抑制剂(HDACi)在体外对多种类型的癌细胞(包括结肠癌、乳腺癌和肝癌等)具有显著的抗肿瘤作用。目前获批的HDACi的适应症主要集中在血液系统恶性肿瘤,如淋巴瘤和骨髓瘤。而HDACi 对人类实体瘤缺乏明显的功效,这限制了其在更多肿瘤适应症中的应用。
最近研究表明,HDAC的抑制将通过级联反应导致乳腺癌中相关药物靶点STAT3的代偿性激活,这可能会限制HDAC抑制剂在实体瘤中的抗增殖作用。本研究中科研人员将HDACi药团与其他蛋白抑制剂结合起来,设计了一系列STAT3-HDAC双靶点抑制剂,以提高针对固体肿瘤的疗效。与BRD4-HDAC和JAK1-HDAC抑制相比,STAT3-HDAC抑制可能是一种有效的替代组合。科研人员选择STAT3抑制剂紫檀芪 (Pterostilbene,PTE) 作为母体分子。PTE是从蓝莓中提取的白藜芦醇的天然二甲基化类似物。通过将HDAC抑制剂SAHA(伏立诺他)的药效团掺入PTE中,合成了一系列具有STAT3-HDAC双靶点抑制活性的强效紫檀芪异羟肟酸衍生物。
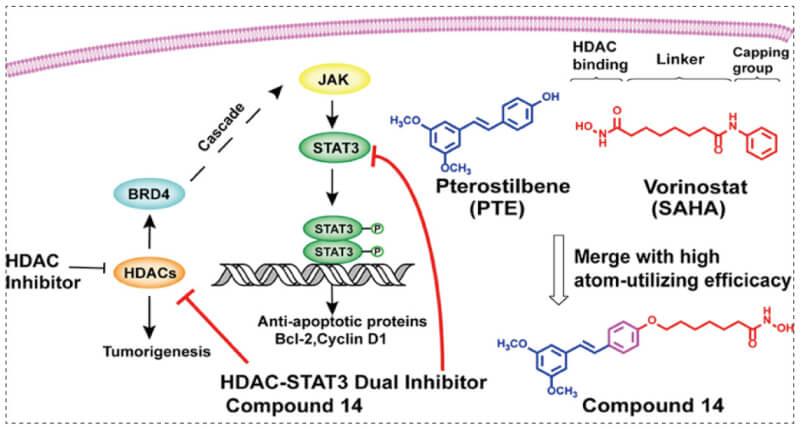
HDAC-BRD4-LIFR-JAK-STAT3 signal cascade[2]
其中,Compound 14 是一种出色的异羟肟酸酯衍生物,可直接与STAT3结合,具有强大的亲和力(KD=33 nM),在体外有效抑制HDAC, IC50为23.15nM。且Compound 14在体内外具有高效的抗增殖能力,抑制MDA-MB-231细胞(IC50=0.78 μM)和 HCT116细胞(IC50= 1.07 μM)。Compound 14在体外实验中表现出良好的抗肿瘤活性,因此研究人员建立了小鼠同种异体移植瘤模型来评价Compound 14的体内抗肿瘤活性。Compound 14在剂量15 mg/kg组与对照组相比体积减少54%,瘤重减少53%。在剂量30 mg/kg组体积减少64%,瘤重减少62%。此外Compound 14没有引起明显的体重变化。实验结果表明,Compound 14具有良好的安全性,是一种很有前途的抗癌化合物。
在此项研究中,科研人员通过美迪西评估了Compound 14在SD大鼠中静脉和口服给药的药代动力学(PK) 数据。下图显示Compound 14具有出色的整体PK曲线:静脉注射Compound 14(2 mg/kg)后,稳态(Vss)的平均分布量为1.65 L/kg。平均血清除率 (Cl)为63.89 mL/min/kg。平均半衰期(T1/2)为0.47h。口服Compound 14(20 mg/kg)后,口服生物利用度(F)平均为5.81%,平均半衰期(T1/2)为0.88h。
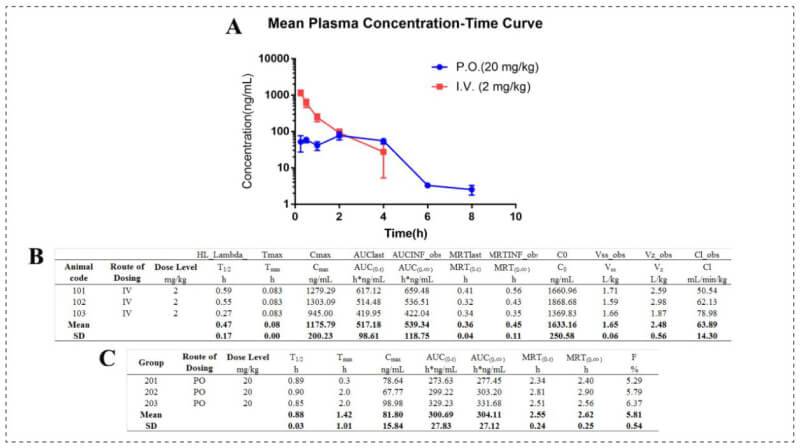
Pharmacokinetics of 14 in SD rats[2]
2023年7月,宇耀生物自主研发的STAT3双功能磷酸化位点靶向抑制剂——YY201临床试验申请正式获得NMPA批准,适应症为晚期实体瘤和复发难治性恶性血液肿瘤。宇耀生物科学家团队一直专注于STAT3靶点的基础和转化研究,并借助AI技术首次发现并开发出了纳摩尔级STAT3双磷酸化位点抑制剂、全球领先的First-in-class小分子靶向药物“YY201”。该药物通过与STAT3直接结合,抑制STAT3的 Tyr705和Ser727双位点磷酸化,抑制STAT3功能和阻断下游信号传递,从而发挥抑制肿瘤作用。体外药理学和药效学研究表明,YY201与STAT3的亲和活性在1-10纳摩尔,在胰腺癌、三阴性乳腺癌、肺癌、急性髓系白血病、淋巴瘤等实体肿瘤和血液肿瘤的体外增殖抑制活性在1-10 nM,在多种体内模型中表现出显著的抗肿瘤作用,极低剂量下可致肿瘤完全消退,药代动力学和毒理学研究亦证实YY201良好的成药性和安全性。
美迪西作为宇耀生物的合作伙伴,为YY201提供了药学研究服务(包括原料药、制剂)、临床前研究服务(包括药效、药代、安评)以及IND申报服务等,助力YY201成功通过IND 审批进入临床试验阶段。
相关阅读: 美迪西助力宇耀生物STAT3双磷酸化抑制剂YY201获批临床
作为众多致癌信号通路的汇聚点,STAT3在调节抗肿瘤免疫反应中发挥着重要作用。STAT3在抑制关键的免疫激活调节因子的表达和促进免疫抑制因子的产生方面发挥着重要作用。
目前,STAT3靶向药物的开发已经进入深度开发阶段。虽然目前市场上还没有相关药物,但已经凸显出巨大的应用前景。未来会越来越重视以STAT3为靶点的药物开发,不断推出新的药物开发技术,如PROTAC技术。STAT3-PROTAC既能抑制STAT3的功能,又能直接降解STAT3,在克服肿瘤耐药性方面有很大优势。因此,靶向STAT3信号通路已成为治疗多种癌症的一种有前途的策略!
[1] Xin Li, et al. STAT3 Inhibitors: A Novel Insight for Anticancer Therapy of Pancreatic Cancer. Biomolecules. 2022 Oct 9;12(10):1450. doi: 10.3390/biom12101450.
[2] Yuhao Ren, et al. Discovery of STAT3 and Histone Deacetylase (HDAC) Dual-Pathway Inhibitors for the Treatment of Solid Cancer. J Med Chem. 2021 Jun 10;64(11):7468-7482. doi: 10.1021/acs.jmedchem.1c00136.
[3]Sailan Zou, et al. Targeting STAT3 in Cancer Immunotherapy. Mol Cancer. 2020 Sep 24;19(1):145.DOI: 10.1186/s12943-020-01258-7
 相关新闻
相关新闻