



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




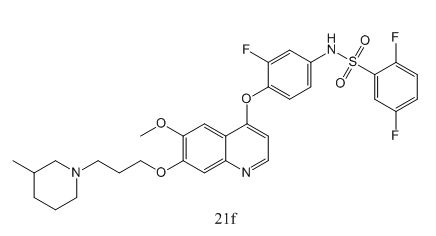
AXL酪氨酸激酶的过度表达或激活与炎症的发生、发展以及肿瘤的侵袭、转移等过程密切相关。然而,针对AXL的研究直到近年来才受到广泛的关注。2013年首个AXL抑制剂进入临床试验,成为AXL作为抗癌靶点的一个重要里程碑。Istvan Szabadkai等人[1]最近提出了一个新的小分子化合物21f,描述了其结构、合成和生物活性,并证实是一种选择性的AXL酪氨酸激酶抑制剂。在未观察到毒性的情况下,在人类乳腺癌异种移植模型中,使用21f后局部肿瘤停滞生长的几率达到40%,这表明21f具有成药的可能性,值得进一步的具体研究和探索。
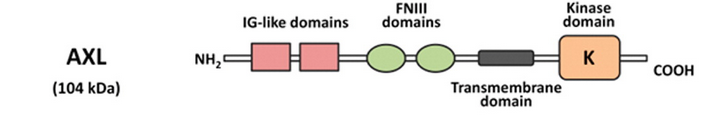
AXL靶点概括
受体酪氨酸激酶(RTKs)是连接细胞外和细胞内环境的跨膜蛋白。作为信号转导的调停者,其在正常的细胞过程中扮演了重要的角色,包括分化、粘附、迁移、凋亡、代谢。哺乳动物的受体酪氨酸激酶中有一个亚科称为TAM家族,包括AXL、MER和TYRO-3。AXL激酶的过表达最初是在慢性粒细胞白血病和慢性骨髓增生症中发现的。随后,Paccez等人发现在乳腺癌、肺癌、前列腺癌、结肠癌、食管癌、肝癌等多种癌症中也存在AXL激酶过表达。
AXL受体酪氨酸激酶是由胞外区、跨膜区和胞内区组成,属于Ⅰ型跨膜单链。其胞外配体结合区域由两个免疫球蛋白的结构域和两个纤维蛋白的重复序列相连而成;胞内段是酪氨酸蛋白激酶的催化部位,具有自身磷酸化的特点。胞外段则通过一个a螺旋跨膜结构与胞内的酪氨酸激酶相连。
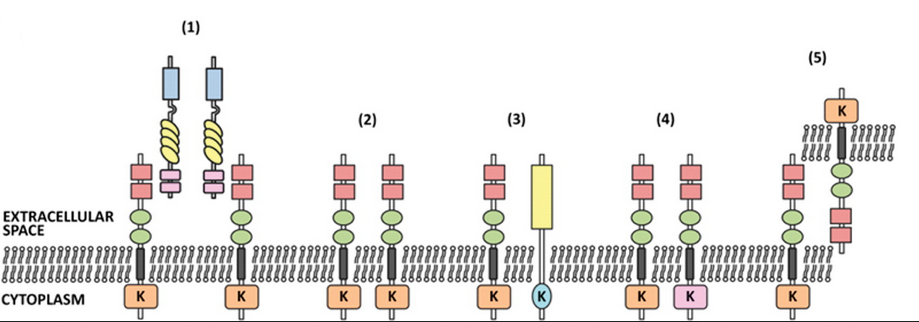
AXL可以被多种机制激活,活化方式具体有:(1)AXL与GAS6配体依赖性活化;(2) AXL的配体独立活化;(3)非TAM家族蛋白对AXL的异源激活;(4) MER或TYRO3对AXL的异源激活;(5) AXL的胞外配体独立活化。最常见的是配体依赖性激活,其中AXL与GAS6结合,形成由两个AXL分子与两个GAS6分子结合的二聚体复合物。其他的激活机制也可能会发生,如当AXL被过度表达或在氧化应激下,往往会发生配体独立激活[2];以及在B细胞慢性淋巴细胞白血病中发现AXL和TYRO3的二聚化[3]。
AXL抑制剂的研究现状
已有研究发现,TAM信号转导在凋亡细胞的清除、固有免疫以及炎症调节反应中起着重要的作用。TAM的信号缺陷可以导致凋亡细胞清除障碍以及固有免疫反应中炎症的无限制级联放大。因此,通过抑制TAM信号转导,可以达到治疗癌症和缓解免疫抑制的效果,并能治疗晚期败血性休克。
近来的研究显示,激活的AXL会帮助癌细胞发展出对厄洛替尼的耐药性,而在细胞中抑制AXL活性,则能恢复细胞对厄洛替尼的敏感性。若将AXL抑制剂和厄洛替尼组合使用则能够实现优势互补。一方面,激酶抑制剂能够快速抑制肿瘤细胞,并增强顽固肿瘤对厄洛替尼的敏感性;另一方面厄洛替尼能够帮助激酶抑制剂发挥持久的抗肿瘤作用。此外激酶抑制剂还能够协助活化T细胞来清除肿瘤细胞。BerGenBio就基于上述观点,专注开发AXL激酶抑制剂,试图将其发展成癌症治疗中联合用药的基石之一。下图为已报道的对AXL有活性的小分子酪氨酸激酶抑制剂。
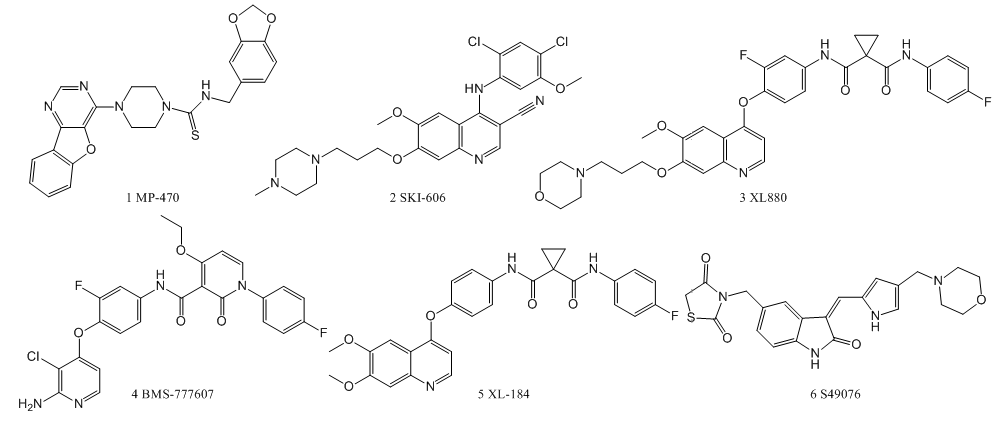
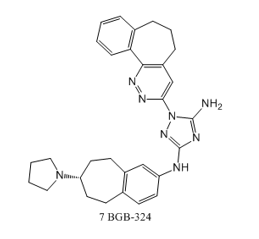
然而,上述小分子激酶抑制剂的起始目标靶点并不是AXL,第一个针对AXL激酶的选择性抑制剂是化合物R428(BGB-324)(7) [4]。其作用机制是抑制AXL的磷酸化,打破膜上AXL激酶的稳态调控,从而下调AXL膜上的表达量。BGB-324是BerGenBio公司研发的同类首创、高选择性、生物可用的口服AXL小分子抑制剂。
AXL在不同实体和癌症的生存、扩散和耐药机制中的突出作用,都表明AXL抑制作为一种抗癌药物,特别是针对晚期疾病,值得期许。目前针对AXL的各种候选药物正在临床研究中,预计会有更多的药物问世,可以为癌症患者提供新的治疗方案。
参考文献:
1, Istvá̈ri,́̈ AxelChoidas, Axel Ullrich and László̋r−6292.
2, Heiring, C. Dahlback, B. Muller, Y. A.Ligand recognition and homophilic interactions in Tyro3: structural insightsinto the Axl/Tyro3 receptor tyrosine kinase family J. Biol. Chem. 2004, 279,6952-6958.
3, Sinha, S. Boysen, J. Nelson, M.;Secreto, C. Warner, S. L. Bearss, D. J. Lesnick, C. Shanafelt, T. D. Kay,N. E. Ghosh, A. K. Targeted Axl inhibition primes Chronic Lymphocytic LeukemiaB cells to apoptosis and shows synergistic/additive effects in combination withBTK inhibitors Clin. Cancer Res. 2015, 21, 2115-2126.
4, Holland, S. J. Pan,A. Franci, C. Hu, Y. Chang, B. Li, W. Duan, M. Torneros, A. Yu, J. Heckrodt, T. J. Zhang, J. Ding, P. Apatira, A.; Chua, J. Brandt, R. Pine,P. Goff, D. Singh, R. Payan,D. G. Hitoshi, Y. R428,a selective small molecule inhibitor of AXL kinase, blocks tumor spread andprolongs survival in models of metastatic breast cancer. Cancer Res. 2010, 70,1544−1554.
 相关新闻
相关新闻