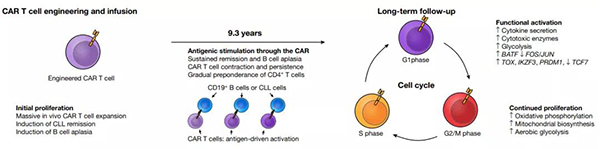
近日,“CAR-T 疗效可持续 10 年” 频上医药新闻热搜!CAR-T 疗法专家之一 Carl June 教授在《Nature》杂志上发表了一篇关于 CAR-T 疗法的重要论文:导入人工合成的 CAR-T 细胞,可以在无瘤生存 10 年以上的白血病患者外周血中依然被检测到,而且这些 T 细胞依然保持活性状态。
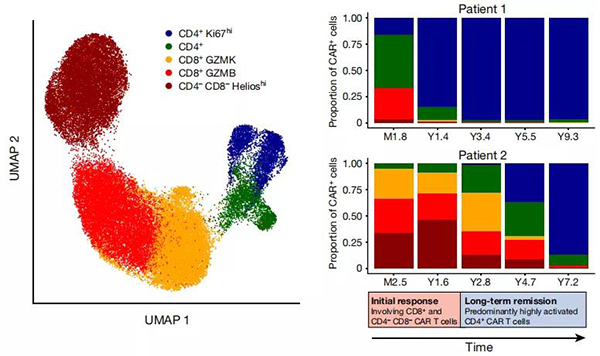
数据显示:Patient 1 在接受 CAR-T 细胞治疗后的第 1.4 年,CAR-T 细胞中的 CD4 T 细胞占比就达到了 97.5%;第 3.4 年,占比超过了 99.6%;Patient 2 在接受治疗后的 7.2 年,CD4 T 细胞的占比达到了 97.6%!这是一个令人惊讶的发现。表面 CD4 T 细胞亚群占比和长期生存可能有着密切联系。这个新的发现将有助于科学家们开发出长期有效的 CAR-T 细胞疗法。
研究人员们指出,这一变化表明两种细胞在治疗不同阶段的作用:CD8 T 细胞负责杀死癌细胞,CD4 T 细胞负责长期对病情的控制。因此想要长久控制癌症,需要多种不同细胞类型的组合。此外,这些结果也再次证明 CAR-T 细胞可以在人体内长久生存。持续增殖、细胞因子表达、代谢活性等体外反应表明,这些长期存在的 CAR-T 细胞保持功能活跃。这些发现为长期 CAR-T 细胞信号传导和持久性的性质和功能提供了新的见解。
❖被动免疫疗法:通过给宿主输入能直接杀伤肿瘤的效应细胞和/或抗体的偶联物以治疗肿瘤。当治疗因子为细胞时,称为过继性免疫疗法。被动免疫疗法不依赖宿主的免疫功能状态。
免疫重建小鼠模型
为了解肿瘤的发病机理、肿瘤侵袭与转移、肿瘤与宿主的关系等,需要建立合适的动物模型。动物肿瘤模型是研究肿瘤发生发展机制的重要手段和工具。而小鼠肿瘤模型的研究,尤其是利用分子生物学手段建立的各种小鼠模型,已经是现在也将是未来进行肿瘤研究的重要方法之一。美迪西现有多种已经验证过的人源化小鼠
肿瘤模型。
在小鼠中重建人类免疫系统(Humanized Immune System,HIS)通常有三种方法:
❖ 将人的外周血单核细胞 (PBMC) 注射到免疫缺陷小鼠体内进行免疫重建,即 PBL-HIS 模型;此模型只能重建人的 T 细胞,因此只能用于评价针对 T 细胞功能的药物。
❖ 接种人的 CD34+ 造血干细胞到经过辐照的免疫缺陷小鼠里进行免疫重建,即CD34+ HSC-HIS 模型;辐照有利于 CD34 细胞在小鼠体内的占位。
❖ 移植胎儿胸腺和胎肝到经过辐照的免疫缺陷小鼠肾包膜下,同时接种人的骨髓造血干细胞进行免疫重建,即 BLT-HIS 模型。此模型虽然重建效果较好,但材料来源一定程度上受伦理限制,很难批量制备,适合于科学研究,却不适合于药物研发所要求的大批量、稳定和可重复要求,因此建模壁垒比较高。
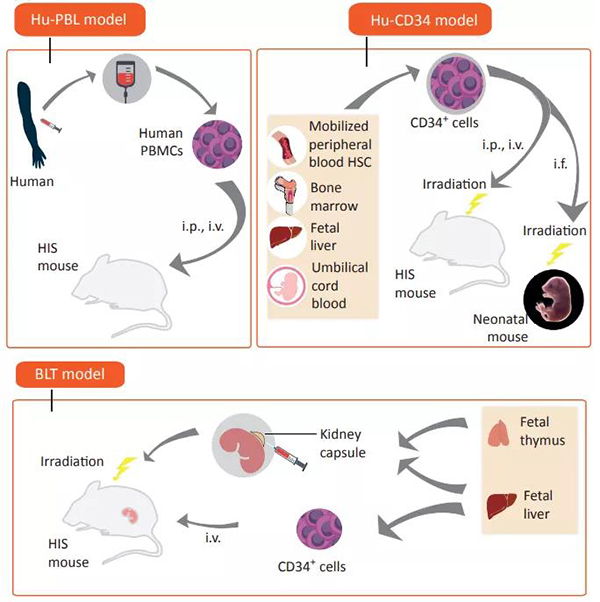
免疫重建小鼠模型的三种方式[3]
美迪西已建立将近300种肿瘤评价模型,同时为创新疗法赋能,全面布局肿瘤免疫疗法的评价和研究,已完成 CAR-T,TCR-T,CAR-NK,溶瘤病毒, 抗体(单抗,双抗,多抗等),siRNA, AAV等免疫疗法的模型建立及药效评价。
❖ PDX模型
人源肿瘤异种移植模型(Patient-Derived Tumor Xenograft,PDX): 将病人的肿瘤组织直接移植到免疫缺陷鼠而建立的,人源异种移植模型在组织病理学、分子生物学和基因水平上保留了大部分原代肿瘤的特点、具有较好的临床疗效预测性。因而,目前该平台广泛的应用于新药开发,尤其是靶点药物的临床试验病人筛选和预测性生物标志物的研究中。
❖ 人源化肿瘤移植模型
人源化小鼠可以方便的模拟人类的生物学特性,对于临床前药效评估模型的建立至关重要,可以为抗体或抗体偶联物(ADC)等生物技术药的测试提供合适的药效模型。
❖ 同种肿瘤移植模型
同源肿瘤移植模型测试模型动物利用其完善的免疫系统对抗癌症的能力及免疫疗法的治疗作用。美迪西根据客户的需求提供各种有效的同种肿瘤移植模型,用来检测药物的有效性。常规的肿瘤疾病有:乳腺癌、肺癌、结肠癌、肾癌、DLBCL 淋巴瘤等,通过大小鼠、仓鼠等进行动物实验。
❖ 原位移植肿瘤
异种原位肿瘤移植模型可以在评价药效时充分考虑肿瘤细胞和其周围间质间的器官微环境之相互作用并监测肿瘤生长。美迪西为您破除试验与技术上的壁垒,目前具有成熟的原位移植技术,包括脑部原位移植,肝脏原位移植,肺原位移植,胫骨骨髓腔原位移植,膀胱内原位移植等。
❖ 异种肿瘤移植模型
美迪西根据客户的需求提供各种有效的异种肿瘤移植模型,用来检测药物的有效性。常规的肿瘤疾病有:头颈、肺癌、乳腺癌、胃癌、胰腺癌等,通过大小鼠、仓鼠等进行动物实验。美迪西致力于为客户提供成熟的评估 ADC 体内药效的肿瘤模型,在 AAALAC认证的环境下完成模型动物的建模和饲养,并以 GLP-like 的高标准完成相关药效学评价试验。
总结与展望
肿瘤治疗的研究方向是多种药物联合治疗、多学科交叉整合。应对这些挑战需要多方面的共同努力,集中资源加速理解肿瘤和免疫间复杂的相互作用,最终为肿瘤患者制定最优化治疗方案,推动肿瘤免疫治疗时代的进步。在癌症发病机制及新疗法的探索之中,临床前抗肿瘤药效评价体系的建立和完善尤为重要和迫切。在肿瘤免疫治疗药物的药效研究种,实验设计是多种多样的。而对肿瘤免疫药物的药效评价,由于涉及很多临床时期的困难,机理复杂,也为药效评价带来了一定的难度。但是,如果能够针对不同的疗法和机制选择合适的药效评价模型,再加上合理的实验设计,则可以让这个艰难的过程事半功倍,取得良好的试验效果!
参考文献
[1] J Joseph Melenhorst, et al. Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature. 2022 Feb 2.
[2] Samik Upadhaya, et al. The clinical pipeline forcancer cell therapies. Nat RevDrug Discov.2021Jul;20(7):503-504.
[3] De La Rochere P, Guil-Luna S, Decaudin D, et al.Humanized mice for the study of immuno-oncology. Trends Immunol. 2018,39(9):748-763.
[4]. Nirali N Shah, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL. J Clin Oncol. 2021 May 20;39(15):1650-1659.
[5]. Elise A Chong, et al. Five-Year Outcomes forRefractory B-Cell Lymphomas with CAR T-Cell Therapy. N Engl JMed. 2021 Feb18;384(7):673-674.
[6]. Zhenguang Wang, et al. Phase I study of CAR-T cells with PD-1 and TCR disruption in mesothelin-positive solid tumors. Cell Mol Immunol. 2021 Sep;18(9):2188-2198.
推荐阅读:











 相关新闻
相关新闻