HER2是重要的乳腺癌预后判断因子,针对该靶点开发的靶向药物种类多样。火石创造(微信:firestone-link)的靶点追踪系统的数据显示,目前已在美国上市的HER2靶向药物有5种,其中两种在中国上市。除此以外,许多关于HER2基因的多项新型药物也正在临床试验中。
HER2受体及其靶向药物
原癌基因人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2),即c-erbB-2基因,因无可溶性的配体而被称为“孤儿受体”。该受体的聚合作用会导致酪氨酸残基磷酸化,并启动多种信号通路导致细胞增殖和癌症发生。
据临床统计,15%~30%的乳腺癌和10%~30%的胃/食管癌会发生HER2基因扩增或过表达。此外,在卵巢癌、肺癌、膀胱癌、头颈癌中也发现HER2基因的过表达。近年来,针对HER2靶点设计的药物一直是研究的热门,火石创造(微信:firestone-link)的靶点追踪系统显示,全球共有171家公司/机构正在研发HER2靶向药物。
目前,已经有5种HER2靶向药物通过了FDA审批,其中两种获CFDA批准在国内上市。
抗HER2的三种大分子药物
在HER2靶点药物的开发上,罗氏成绩显著。目前已上市的5种药物中,3种均由罗氏原研,分别是曲妥珠单抗、帕妥珠单抗以及Kadcyla。
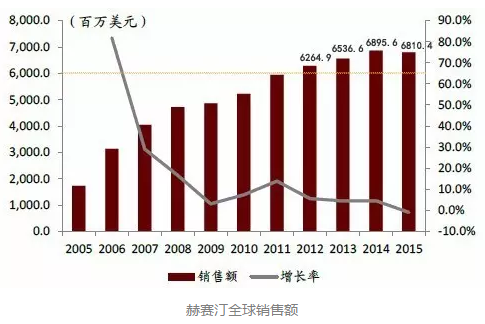
专利到期赫赛汀年销售额下滑
1998年,赫赛汀(曲妥珠单抗)获FDA批准上市。作为最早上市的HER2靶向药物,赫赛汀主要适用于乳腺癌、胃癌、胃食管交界腺癌。赫赛汀于2000年在欧洲上市,2001年在日本上市,中国CFDA也在2002年批准了赫赛汀的上市销售。
作为罗氏的原研产品,2012年,赫赛汀全球销售额突破60亿美元,之后一直保持稳定。由于2015年赫赛汀在美国的专利到期,大量仿制药开始上市,导致价格下滑,市场规模也随之出现萎缩。
乳腺癌是我国女性发病率最高的癌症,每年有近20万女性被诊断出乳腺癌。赫赛汀作为治疗HER2阳性乳腺癌的一线用药,在我国有很大的市场刚性需求。2002年CFDA批准赫赛汀在中国上市以来,该产品在国内重点医院的年销售额一直保持着增长趋势,至2015年达到了6.6亿人民币。
但是赫赛汀治疗费用偏高,国内渗透率仍比较低。而考虑到赫赛汀已过了专利保护期,未来大批仿制药的出现以及更多的省市将其纳入医保目录,将有可能使赫赛汀在国内的渗透率快速提升。
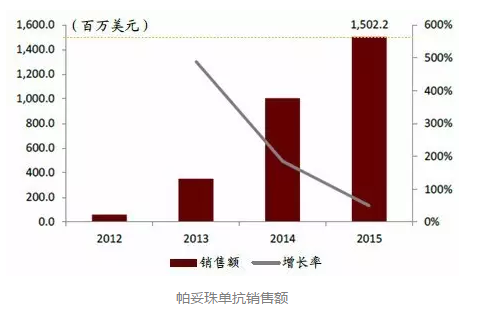
被称为“HER二聚化抑制剂”的帕妥珠单抗
Perjeta(帕妥珠单抗)是针对HER2的单克隆抗体药物。最初由Genentech公司研发,2009年罗氏收购Genentech并掌握Perjeta。2012年Perjeta被FDA批准上市,2013年该药品在欧洲和日本上市,全球销售额快速增长,2015年突破15亿美元,现已成为乳腺癌的二线治疗药物,但我国CFDA目前还未批准Perjeta在国内市场销售。
帕妥珠单抗可阻断HER2受体的二聚化,从而阻滞该受体被激活,但它和配体的结合位点与曲妥珠单抗不同,被批准与曲妥珠单抗和多西他赛等联合用于未经激素治疗或化疗等既往治疗的HER2阳性转移性乳腺癌患者。
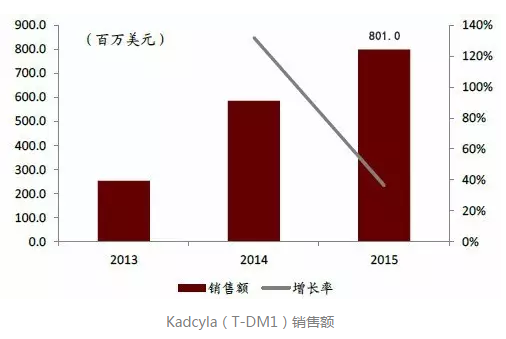
新型抗HER2的ADC药物
大多数HER2阳性转移性乳腺癌患者最终会产生耐药性。Kadcyla(ado-trastuzumab emtansine,简称T-DM1)同为罗氏研发,是由曲妥珠单抗和细胞毒性组成的ADC药物,它可以靶向作用于HER2过表达细胞来克服耐药机制。
Kadcyla于2013年获FDA批准上市,作为单药用于经曲妥珠单抗和紫杉醇药物分别或联合既往治疗的HER2阳性转移性乳腺癌患者。同年,该药在日本和欧洲相继获批上市,同Perjeta一样,现已成为乳腺癌二线治疗药物,2015年全球销售额突破8亿美元。
FDA批准Kadcyla时有一项黑框警告,提醒患者和医生:该药可引起肝脏毒性、心脏毒性和死亡,在使用前要进行妊娠试验。目前CFDA还未批准该药在国内上市。
抗HER2的两种小分子药物
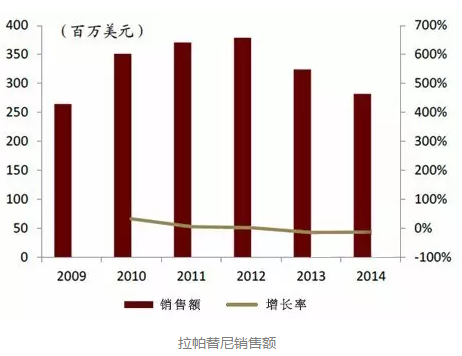
销量相对较小的泰立沙
泰立沙(拉帕替尼)是另一种在中国上市的HER2靶向药物,于2007年获FDA批准上市,2008年在欧洲上市,2013年被CFDA批准在中国上市。
泰立沙是由葛兰素史克(GSK)原研的一种口服小分子表皮生长因子络氨酸激酶抑制剂,被批准可与卡培他滨联合用于经蒽环类药物、紫杉醇及曲妥珠单抗既往治疗的HER2过表达的晚期或转移性乳腺癌患者。作为小众药,小分子口服制剂泰立沙销量相对较小。
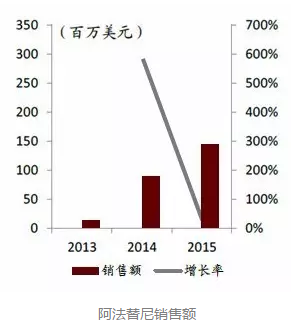
通过FDA孤儿药认证的阿法替尼
另一种小分子HER2靶向药物是Gilotrif(阿法替尼),它于2013年获FDA批准上市,由勃林格殷格翰原研并销售。该药适用于晚期非小细胞肺癌(NSCLC)的一线治疗及HER2阳性的晚期乳腺癌患者。
此外,阿法替尼还通过了FDA的孤儿药认定。欧盟药物管理机构于2013年核准“阿法替尼”用于医治因表皮生长因子受体(EGFR)突变的非小细胞肺癌患者。中国台湾地区行政院卫生署食品药物管理局(TFDA)也于2013年核准阿法替尼药物上市。
基于火石创造已有的数据持续更新的靶点追踪系统,我们可以了解到更多关于HER2阳性转移性乳腺癌的多项新型药物正在临床试验中,下表罗列了部分已完结和在研的新型药物,更多信息可以登录火石官网查看。











 相关新闻
相关新闻