



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




转化医学以药物研发过程中生物标志物为核心,以精准医疗提高药物研发临床应答率为目标,覆盖从早期靶点确认——临床前R&D ——临床I、II、III期Development,到上市后的药物检测,通过不同阶段的研究实现药物研发的闭环。
美迪西转化医学平台拥有经验丰富的专业化技术团队,从药物靶点的作用机制和生物标志物的临床应用出发,以生物标志物的发现和验证为基础,结合多种不同的技术平台和先进的仪器, 创建了多种生物分析方法,降低了药物研发的成本和时间,为不同类型的药物、不同类型的药企和不同研发阶段的项目提供多元高效的服务。
随着基因组学、蛋白质组学和代谢组学等多组学分析技术不断地发展,治疗方式已经从传统小分子扩展到多肽、蛋白、抗体、基因疗法、细胞疗法等多种新型技术。尽管有这些新技术,但仍有大量疾病的致病原因还无法彻底明白。转化医学将生物医学观察和研究转化为改善健康的干预措施的过程,加速了基础研究、新药开发的和临床转化的进程,成为精准靶向治疗的加速器。转化医学研究利用各种研究手段,确定靶点与疾病发生发展的关系、验证和探索药物的作用机制、发现生物标志物并开发伴随诊断产品,以及为临床研究开展筛选最合适的人群和适应症等,从而提高新药研发效率和成功率。
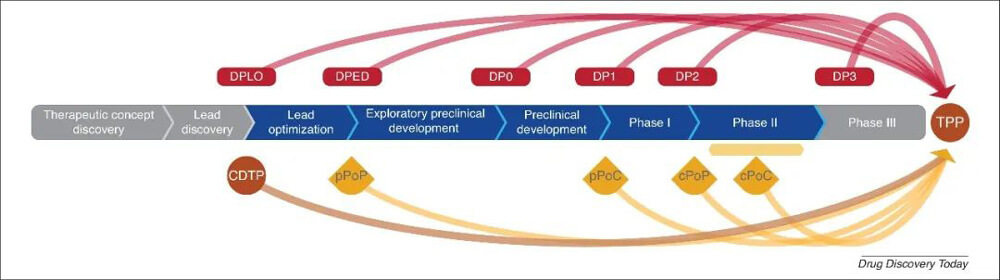
将转化医学里程碑叠加到药物开发阶段[1]
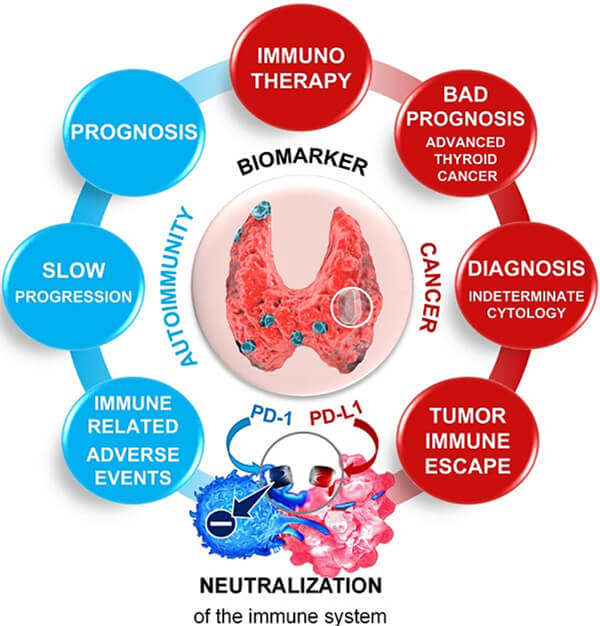
生物标志物(Biomarker)通常是指能被客观测量和评价,反映生理或病理过程,以及对暴露或治疗干预措施产生生物学效应的指标。生物标志物多来源于人体组织或体液,可涵盖生理、生化、免疫、细胞和分子等水平的改变。
生物标志物的检测可广泛地应用与病人的筛查、诊断、临床研究、指导用药、预后等领域。可提高基于基因组学、蛋白组学、细胞组学、病理组学等多组学的生物标志物发现及验证服务。为生物标志物研究提供科学支持,多层面助力新药研发临床试验。生物标志物作为最直接快速有效的诊断手段,其筛选与获得可在疾病诊断、发展、治疗、以及疗效监测等多个方面发挥重要的作用。生物标志物有基于DNA的、有基于RNA的、还有基于蛋白质的,不同的分子和蛋白需要不同的技术平台。随着高通量基因组学、蛋白质组学等的不断进展,生物标志物包括的种类也越来越多,例如SNP、外泌体、miRNA、lncRNA等都被列入生物标志物的行列。目前已有多种技术平台被应用于生物标志物研究,如包括基因组学、蛋白质组学、肽组学、代谢组学等在内的组学平台,以及包括纳米技术、生物信息学、抗体芯片、高内涵筛选技术、无标记相互作用分析技术等多种前沿技术在内的手段与方法,都为快速获得及筛选生物标志物带来了极大的可能。
❖ 诊断性生物标志物:用于检测或确认疾病状态,或识别不同疾病亚型。
❖ 预后性生物标志物:反映疾病预后特征、疾病复发或进展风险。
❖ 预测性生物标志物:用于预测患者对某种治疗或干预措施可能产生某种疗效应答。
❖ 药效学生物标志物:反映患者在接受治疗后产生某种生物学应答。
❖ 安全性生物标志物:用药前或用药过程中监测从而避免或降低患者发生不良反应。
❖ 监测性生物标志物:监测疾病状态变化(如复发等)。
❖ PD1/PD-L1
❖ ErbB2/HER2
❖ p-FGFR1/FGFR2/FGFR3、p-ERK、p-CREB、p-AKT
❖ EGFR
❖ VEGF
❖ p53
❖ Cyclin D1
❖ COX-2
❖ Cytokeratin 7(CK7)
❖ K-Ras
❖ SOX2
❖ MET
❖ Fas
❖ ER-α
❖ Ki-67等
WBC100 是一种新型口服有效的分子胶,可选择性地降解 c-Myc 蛋白而对其他蛋白无作用活性,并有效杀死c-Myc过表达的癌细胞。SPR结果显示 WBC100 与 c-Myc 蛋白结合,且存在剂量依赖性。此SPR实验正是通过美迪西使用Biacore T200仪器进行的。
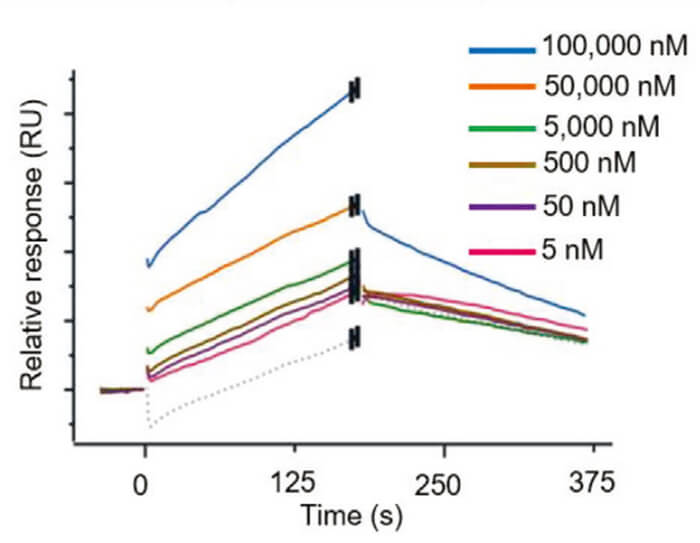
Surface plasmon resonance (SPR)[2]
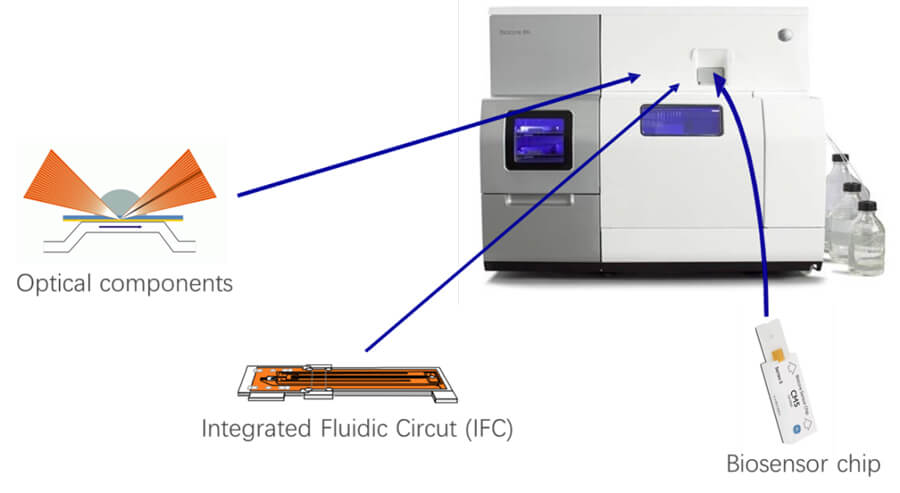
❖ 8 needles and 16 flowcells, study 8 targets at the same time;
❖ High-throughput, 500 compounds/day;
❖ Fast detection speed,finish one affinity and kinetic test in 2-15 minutes.

A: Binding kinetics of different doses of Nivolumab with PD-1 (Biacore 8K)
B: Binding kinetics of different doses of Aflibercept with recombinant human VEGF (Biacore 8K)
美迪西生物分析部可以为客户提供小分子药物、大分子生物制品、生物标志物的筛选与开发,以及临床前和临床阶段的研究服务。可以提供符合FDA/NMPA GLP的生物技术药物生物分析服务,以支持蛋白药物、抗体药物、疫苗、生物标志物、细胞和基因治疗药物的早期开发,及其临床前研究和临床研究。
❖ 免疫分析方法的开发及方法学验证
❖ 蛋白、抗体、ADC、多肽药物、核酸、疫苗及细胞与基因治疗产品等的分析
❖ 生物标志物的筛选、验证与分析、细胞因子检测
❖ 抗药性抗体(ADA)免疫原性分析
❖ 疫苗的免疫原性分析
❖ 病毒的活性分析
❖ 疫苗的效价测定
❖ 临床样品生物分析
❖ 支持PK 药代动力学、TK 毒代动力学、组织分布试验、IND申报
❖ 实验室实行全面的信息化管理,运用验证过的实验室信息管理系统(Watson LIMS 7.2)建立了完善的样品管理链和实验数据的处理、跟踪与存储链;
❖ SensaTronics温度监控系统;
❖ 验证过的WinNonlin 软件用于数据分析;
❖ 数据被FDA和NMPA接受,提供全面符合FDA/NMPA/OECD GLP规范要求的生物技术药物分析服务;
❖ 独立的小分子生物分析平台和生物技术药分析平台;
❖拥有SpectraMaxM4/M5/i3x, MSD, Luminex, Biacore 8K, Envision,Gyrolab,ABI7500 qPCR、ddPCR、FACS等全方位多功能的技术平台;
❖ 灵活运用ELISA,ECL,IP,Co-IP,qPCR,ddPCR、FACS,Elispot、酶学、Cell-based 等多种方法,支持前沿生物药,种类包括蛋白、抗体、ADC、多肽、核酸、疫苗及细胞基因治疗药物的早期开发,及其临床前研究和临床研究;
❖ 开发并验证针对近百个不同靶点,如CD-4,CTLA-4,PD-1,PD-L1及T-DM1类似物ADC等的分析方法,支持PK/TK/免疫原性(Total ADA, Nab)/生物标志物/细胞因子等分析。

往期文章中,我们通过从FACS 检测 Cytokine 检测和细胞功能检测多个实际案例的角度出发,详细介绍了“美迪西流式细胞技术平台”(点击了解)。截至目前,美迪西承接的流式检测项目已经近400项,包括细胞表面抗原表达的流式检测;细胞增殖、细胞分化、细胞凋亡等的流式分析;动物外周血及各免疫器官检测;移植瘤模型流式检测等。美迪西流式检测团队将每一个案例的特点与多年实战经验和技术积累相结合,谨慎地将优质实验结果提交到客户手上,持续助力客户的研发项目获批。
免疫组化,也称免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。是指应用免疫学基本原理即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究。根据抗原抗体反应和化学显色的原理,组织切片或细胞样本中的抗原先和一抗结合,再利用一抗与二抗反应,DAB进行显色,进而进行分析。
❖ 组织处理、固定、切片
❖ 抗原修复
❖ 除去内源性过氧化物酶
❖ 封闭
❖ 一抗、二抗孵育
❖ 检测
❖ 复染
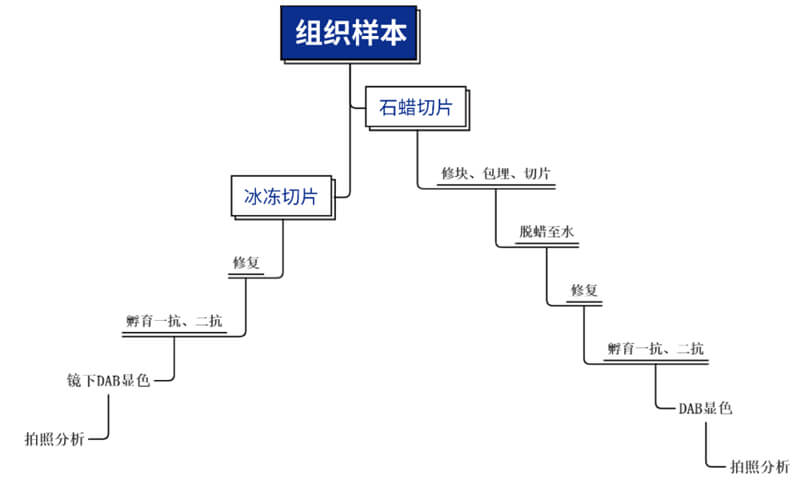
组织固定可保存抗原,防止采集的组织自溶和坏死。组织包埋可在切片过程中对组织提供支撑,使切片更坚实。
| 石蜡切片 | 冰冻切片 | |
| 固定 | 包埋前:甲醛 | 切片前或切片后:甲醛、甲醇、乙醇或丙酮 |
| 切片 | 切片机 | 冰冻切片机 |
| 储存 | 室温下储存多年 | -80 °C下储存1年 (-190°C下储存时间更长) |
| 优势 | 容易操作,不会损坏切片 | ♦ 保留酶的功能和抗原性 ♦ 实验流程简短(通常不需要冗长的固定步骤) |
| 局限性 | ♦ 过度固定会掩盖抗原表位,进而增加抗原修复的需求 ♦ 处理时间长:在梯度酒精和二甲苯中逐步脱水,以便于石蜡渗透。 | ♦ 如果没有快速冷冻组织”可能会形成冰晶,从而破坏组织结构 ♦ 冰冻切片通常比石蜡切片厚,可能会导致分辨率低、图像差 ♦ 可能需要阻断内源活性酶。 |
石蜡切片 vs冰冻切片
对甲醛固定的组织切片进行抗原修复,以暴露抗原位点,从而使抗体结合。
| 热诱导的抗原表位修复 | 蛋白水解酶诱导的抗原表位修复 | |
| 优势 | 抗原表位的修复更温和,参数更可控。 | 适用于较难修复的抗原表位。 |
| ph值 | 通常使用pH6的缓冲液,但碱性缓冲液也在广泛使用。必须通过实验确定 | pH值通常为7.4。 |
| 温度 | 约95°C。 | 通常为37°C |
| 孵育时间 | 10-20分钟 | 10-15分钟 |
| 缓冲液组分 | 取决于靶抗原所需的pH 值。常用的缓冲液包括柠檬酸钠、EDTA和Tris-EDTA | 酶(如胃蛋白酶、蛋白酶K 或胰蛋白酶)的中性缓冲液。 |
| 注意事项 | 微波炉加热可能会导致抗原修复不均匀。剧烈沸腾会导致脱片(组织与载玻片分离)。 | 酶修复有时会破坏切片的形态- 浓度和时间需要优化 |
抗原修复的主要方法
用血清或BSA封闭,防止抗体的非特异性结合,并降低背景和潜在的假阳性结果。
❖ 蛋白封闭:使用血清或BSA 进行封闭对于防止抗体与组织或Fc 受体(与抗体恒定区(Fc)结合的受体)发生非特异性结合至关重要。二抗种属来源的血清是很好的封闭试剂。使用牛血清白蛋白(BSA)或酪蛋白,可用于阻断非特异性抗体结合。
❖ 生物素封闭:在使用基于亲和素/生物素的检测系统时,阻断内源性生物素,因为内源性生物素存在于许多组织中,特别是肾脏、脾脏、肝脏和大脑中。用亲和素与组织孵育,阻断内源生物素,然后用外源生物素孵育,以阻断亲和素分子上额外的生物素结合位点。
用血清或BSA封闭,防止抗体的非特异性结合,并降低背景和潜在的假阳性结果。
❖ 酶显色法:显色检测使用酶能够催化可溶性底物产生有色沉淀。这些酶通常偶联在二抗上,也可以偶联在一抗上用于直接检测。最常用的酶有HRP 和AP,前者将DAB 转化成棕色产物,后者将3-氨基-9-乙基咔唑 (AEC) 转化成红色产物。显色检测通常比荧光检测更灵敏。此外,不同于荧光染料,有色沉淀物有光稳定性,因此染色切片能够保存多年。荧光检测需要使用专业荧光显微镜和滤光片,显色检测仅需使用标准显微镜。然而,显色检测的孵育和封闭步骤比荧光法更多,时间也更长。
❖ 荧光法:荧光检测(免疫荧光)是基于荧光基团被特定波长的光激发后发射波长较长的荧光的特性。荧光检测常常用于需要同时检测多种抗原的情况。荧光染料可以与一抗或二抗直接偶联,也可与链霉素亲和素偶联。
仪器设备(部分举例)
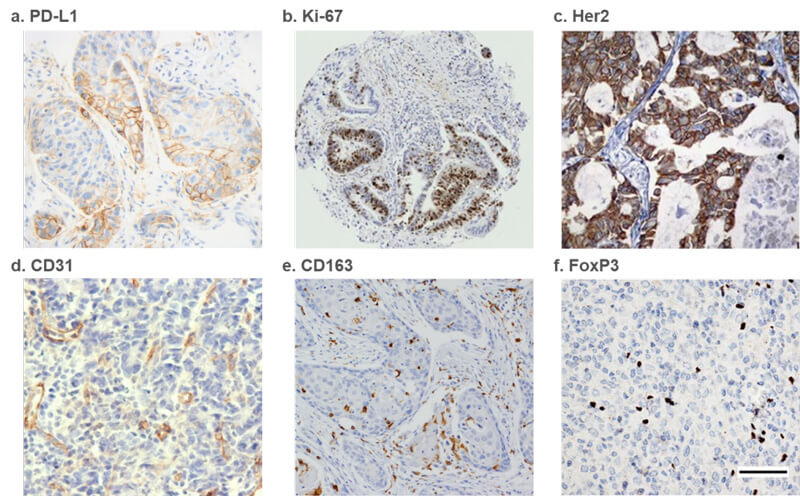
IHC Analysis of the expression of a)PD-L1 from lung adenocarcinoma[3]; b)Ki-67 from periampullary tumors[4]; c)Her2 from lung tumor[5]; d)CD31 from human gastric adenocarcinoma[6]; e)CD163 (M2 TAM marker) from oral squamous cell carcinoma (OSCC)[7]; f)FoxP3 from human glioblastoma[8].
基于基因组学、蛋白组学、细胞组学及病理组学等综合性转化医学平台;高质量的研发管理团队;美迪西转化医学平台致力于为全球合作伙伴提供全方位生物标志物发现、靶点验证、伴随诊断开发与商业化检测等一体化解决方案。
❖ 以ELISA、ECL(MSD), SIMOA(HD-X), Biacore 8K 技术构建的的蛋白质相互作用,蛋白水平生物标志物平台;
❖ 以流式细胞术(BD Symphony A3,BD Fortesssa, Beckman CytoFLEX S)为主构建的细胞水平生物标志物平台;
❖ 以荧光定量PCR技术构建的多重核酸水平生物标志物平台;
❖ 免疫组化(TAMs-IHC,FISH)技术构建的病理水平生物标志物平台等;
致力于解决创新药物的研发难点,助力精准医疗!
我们很幸运地生活在一个生物医学科学看似无限可能的时代。在这个时代,研究的问题不再主要受技术能力的限制。转化医学的实现需要同样持续大胆的愿景和执行。在过去几十年,转化医学取得了显著进步,未来转化医学将继续发展,并更快、更高效地为更多患者提供更多治疗的可能性!
[1] Hugues Dolgos, et al. Translational Medicine Guide transforms drug development processes: the recent Merck experience. Drug Discov Today. 2016 Mar;21(3):517-26. doi: 10.1016/j.drudis.2016.01.003.
[2] Ying Xu, et al. A Selective Small-Molecule c-Myc Degrader Potently Regresses Lethal c-Myc Overexpressing Tumors. Adv Sci (Weinh). 2022 Mar;9(8):e2104344. doi: 10.1002/advs.202104344.
[3] Jonas J Heymann, et al. PD-L1 expression in non-small cell lung carcinoma: Comparison among cytology, small biopsy, and surgical resection specimens. Cancer Cytopathol. 2017 Dec;125(12):896-907. doi: 10.1002/cncy.21937.
[4] Mark M Aloysius, et al. Predictive value of tumor proliferative indices in periampullary cancers: Ki-67, mitotic activity index (MI) and volume corrected mitotic index (M/V) using tissue microarrays. World J Surg. 2010 Sep;34(9):2115-21. doi: 10.1007/s00268-010-0681-3.
[5] Montse Verdu, et al. Cross-reactivity of EGFR mutation-specific immunohistochemistry assay in HER2-positive tumors. Appl Immunohistochem Mol Morphol. 2015 Sep;23(8):565-70.
[6] Qingling Wang, et al. EPCR promotes MGC803 human gastric cancer cell tumor angiogenesis in vitro through activating ERK1/2 and AKT in a PAR1-dependent manner. Oncol Lett. 2018 Aug;16(2):1565-1570. doi: 10.3892/ol.2018.8869.
[7] Faustino J Suárez-Sánchez, et al. Macrophages in Oral Carcinomas: Relationship with Cancer Stem Cell Markers and PD-L1 Expression. Cancers (Basel) (IF: 6.13; Q1). 2020 Jul 2;12(7):1764. doi: 10.3390/cancers12071764.
[8] Qi Yue, et al. The prognostic value of Foxp3+ tumor-infiltrating lymphocytes in patients with glioblastoma. J Neurooncol. 2014 Jan;116(2):251-9. doi: 10.1007/s11060-013-1314-0. Epub 2013 Nov 26.[9] Christopher P Austin.Opportunities and challenges in translational science. Clin Transl Sci. 2021 Sep;14(5):1629-1647. doi: 10.1111/cts.13055.
 相关新闻
相关新闻