



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




通常来说,生物等效性(BE)试验是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验。对于仿制药来说,生物等效性(BE)试验是一个判定仿制药与参比制剂或对照药物最终是否一致的“金标准”。
但是对于一些药物,例如磷结合剂或胆汁酸结合剂等制剂来说,该类药物因无法吸收入血,仅在胃肠道局部产生作用,无法通过测定血药浓度的方法,来比较不同制剂间的差异推测其临床治疗效果的差异性,对于该类型制剂,参考FDA、EMA和NMPA等相关指导原则或指南,可采用体外研究如结合平衡试验和结合动力学试验作为有效性评价的方法,以代替传统的药代动力学为终点的人体生物等效性研究。
美迪西制剂部门胃肠道药物体外生物等效性(BE)研究服务平台是在依托良好的质量体系、多样的质量分析研究设备和丰富的药物研究及申报经验基础上,建立的主要针对在胃肠道产生局部作用且无法进行体内等效性评价的药物开展相关试验的研究平台,致力于为客户提供仿制药开发中的体外生物等效性研究服务,并有该类药物的研究评价和申报经验。
◆ 适用于体外生物等效性评价研究的药物
◆ 体外磷结合平衡研究试验及动力学试验
◆ 体外胆汁酸盐结合平衡试验及动力学试验
◆ 体外HSA或BSA蛋白结合试验
◆ 体外胃蛋白酶结合试验(酶活性抑制研究)
◆ 体外BE方法开发及验证
◆ 体外BE统计分析及判定
◆ 其他需要采取体外酶结合或蛋白结合试验预估新药或新化合物在胃肠道作用的研究
• 检测方法开发
• HPLC or UV or IC or MS
• 方法学验证
• 专属性
• 灵敏度
• 定量限
• 线性
• 重复性
• 中间精密度
• 准确度
• 耐用性(检测方法及仪器参数)

• 样品状态及预处理
• 被吸附物浓度范围最大浓度
• 孵育时间
• 其他参数
• 标难溶液曲线
• 重复至少12组
• 空白试验

• 样品状态及预处理
• 被吸附物浓度2~3个
• 孵育时间
• pH值监测及稳态时间
• 标难溶液曲线
• 结合百分比和结合量
• 空白试验
• 重复至少12组
• 快速上升段及平合特征
• 结合比率

• Langmuir方程计算k1、k2
• 90%置信区间
• 自由度
• T检验或f2相似法
• 其他

• 研究例数与统计
• 异常原因调查
• 最终处理与判定
对于在胃肠道产生局部作用且无法进行体内等效性评价的药物,美迪西也拥有相关项目品种的体外生物等效性评价经验,如碳酸司维拉姆片、硫糖铝口服混悬液等,且部分相关项目已推进至CDE评审阶段。
美迪西重视研究项目质量的合规性、真实性和完整性,严格按照FDA、NMPA相关法规和指南开展研究试验,有多次接受并通过国家药品审评中心项目现场核查的经验。截止目前,参与研发完成的新药及仿制药项目已有超过385件获得批件。
美迪西制剂部门分析团队拥有丰富的新药与仿制药方法开发、验证及申报经验,熟悉国内外注册法规对于体外生物等效性研究的法规要求,部门负责人深耕药物研究几十年,在制剂研究及药品注册方面经验丰富,项目负责人拥有相关体外生物等效性研究的项目经验,且有多个主要负责的新药项目和仿制药研究项目获得批件。
美迪西成立近20年以来,致力于为全球企业、研究机构及科研工作者提供全方位的临床前新药研究服务(包括原料及制剂药学研究、药代动力学和安全性评价研究、IND注册申报等)和仿制药药学研究服务(包括仿制药逆向解析,处方工艺研究、质量控制研究及稳定性研究、体外生物等效性评价等)。配备各类优质且齐全的质量分析研究设备(如多品牌HPLC和溶出仪、UPLC、LC-MS、IC、GC、生物分析仪、叠加式恒温培养振荡器(可容纳40个500ml固定架)等),以匹配不同研究剂型或分析检测目所需,研究项目涉及固体、液体、注射剂、半固体、吸入制剂、脂质体等不同类型的制剂,助力客户项目顺利获批,加速新药研发进程和仿制药的上市。


| 品名 | 作用机制 | 服用方法 | FDA指南体外BE评价方式 | 内容 |
| 碳酸司维拉姆片 | 不会被人体吸收的交联聚合物, 口服进入胃部后,在胃酸的作用下,生成盐酸司维拉姆,这些胺基会在肠道内以离子交换与磷酸分子结合,形成不溶于水的磷酸司维拉姆复合物,最终通过食物残渣和粪便排出体外。 | 随餐服用 | API的一致性 | 包括固态NMR(13C-1H偏振)、IR、拉曼、DSC、XRD、EA、碳酸盐含量、总可滴定胺、溶胀指数和粒度分布等 |
| 磷酸盐结合平衡试验 | 处理:无酸处理的pH4和pH7 | |||
| 处理:经酸处理的pH4和pH7 | ||||
| 磷酸盐结合动力学试验 | 处理:无酸处理的pH4和pH7 浓度:最低浓度和最高浓度 | |||
| 处理:经酸处理的pH4和pH7 浓度:最低浓度和最高浓度 |
关键参数:
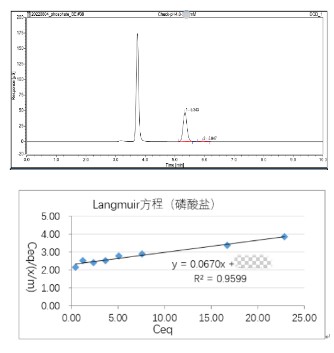
※ 酸浓度及体积
※ 酸预处理时间
※ 不同浓度磷酸盐设置
※ pH值监测与稳态时间
※ 孵化时间
| 品名 | 作用机制 | 服用方法 | FDA指南体外BE评价方式 |
| 硫糖铝口服混悬液 | 胃黏膜保护剂,用于慢性胃炎及缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸。在酸性环境中与胃内渗出蛋白质结合成凝胶状覆盖于胃黏膜表面,阻止 H 弥散。结合胃蛋白酶使其失活 | 餐前1小时及睡前服用 | API的一致性研究 |
| 胆汁酸盐结合平衡试验 | |||
| 胆汁酸盐结合动力学试验 | |||
| BSA结合试验 | |||
| 胃蛋白酶结合试验 |
关键参数(胆汁酸盐结合):
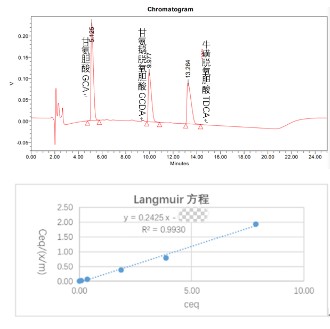
※ 酸浓度及体积
※ 酸预处理时间
※ 胆汁酸盐组成及浓度设置
※ pH值
※ 稳态时间
※ 孵化时间
关键参数(胃蛋白酶结合):
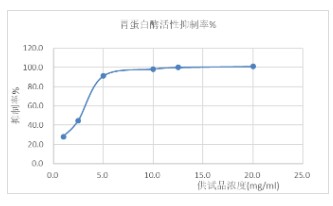
※ 胃蛋白酶浓度
※ 反应过程控制
※ 酸浓度及体积
※ 酸预处理时间
※ 检测方法
 相关新闻
相关新闻