疫苗被认为是针对传染病的最有效的全球卫生干预措施之一,当下和未来的疫苗研发都面临着更加有效和多样化的保护反应以及越来越严格的安全系数的挑战。开发新疫苗方法和制剂的主要挑战是增加有效的免疫激活,导致保护性应答,同时限制过度的炎症。为了增强免疫反应,研究人员已经研究了Toll样受体激动剂作为疫苗佐剂,因为它们可以激活先天免疫系统,促进多种免疫基因的表达,包括对T细胞重要的炎性细胞因子和细胞表面受体。有效的TLR激动剂可刺激所需的细胞或体液适应性反应,并已成功开发出几种疫苗,然而无法直接调节炎症增加了疫苗成本并延缓了其应用。现在有多种成功的TLR激动剂可用于疫苗,但是新的和高剂量的TLR激动剂面临的挑战之一是过度活化或全身分布引起的过度炎症。
改善佐剂反应是开发针对某些病原体疫苗的最有希望的途径,佐剂开发中的一项最大的挑战就是调节炎症反应,同时保持免疫激活和保护作用。目前尚无批准具有独立调节炎症和保护作用能力的佐剂。在这里,研究人员展示了一种增强保护反应同时限制炎症的方法。为了实现这一目标,研究人员将部分选择性核因子κB(NF-kB)抑制剂与几种目前的佐剂联合使用,所得疫苗可减轻全身性炎症并增强保护性反应。研究人员证明了这种方法可以增强保护,并且该方法已在多种佐剂和抗原中进行了测试,不仅可以减少炎症,还可以增强对流感、HIV等病毒的保护性反应,最终也可以用于开发新冠疫苗,该项研究成果近日发表在《Science Advances》上。

检查CpG诱导的炎症和产生的免疫反应
研究人员试图验证SN50可以使抗原呈递细胞上调细胞表面受体,同时限制促炎细胞因子的产生。将小鼠骨髓的来源树突状细胞与SN50和CpG或CpG单独孵育了6小时,并分析了增效剂如何改变细胞因子的产生和细胞表面受体的表达。细胞内细胞因子染色显示,用SN50处理的细胞表现出表达TNF-α和IL-6的细胞明显减少。同时,CD86表达显著增加并且CD40表达持续。因为p65-p50二聚体是在静息细胞中发现的最丰富的二聚体,并且参与炎症细胞因子的产生,所以推测通过抑制该二聚体可以在限制炎症细胞因子的同时实现细胞表面受体的转录和翻译。
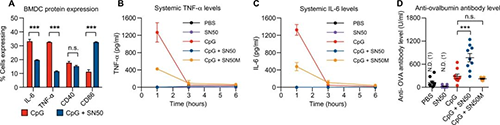
用模型抗原OVA和免疫佐剂SN50进行的体内疫苗接种(来源:Science Advances)
在观察到SN50可以限制炎症而不降低体外细胞表面受体的表达后,研究人员接下来想在体内研究这种作用。为了确定对NF-κB的抑制是否可以降低与CpG疫苗接种相关的促炎细胞因子TNF-α和IL-6的全身水平。在人体中,全身性TNF-α与局部副作用(例如注射部位肿胀和疼痛)相关,全身性IL-6与疫苗接种后的全身系统副作用(例如疲劳和头痛)相关。此外,这两种细胞因子在全身分布时均充当热原,会导致发烧反应。研究人员在所有组中注射后1、3、6、24和48小时测量了这些促炎细胞因子,以确定响应CpG疫苗接种时细胞因子达到峰值的时间点。为了确定SN50如何影响体液反应研究人员在第28天分析了血清抗体水平,为了广泛确定SN50的添加如何影响抗体水平使用酶联免疫吸附测定来测量总Ig(G + A + M)。与单独的PBS相比,CpG组的抗OVA抗体增加了2.4倍。接种了CpG + SN50的小鼠比PBS组增加了5.9倍,而CpG组增加了2.7倍。这些数据证实了添加SN50会增强下游的适应性反应,从而导致免疫增强。由于疫苗接种后适应性反应的增加和耐受性的改善,研究人员将SN50归类为免疫增强剂。
体内流感激发模型的免疫增强
接下来研究人员将重点关注SN50如何过渡到具有病毒挑战的疫苗。研究人员选择流感疫苗作为概念验证疫苗,是因为它具有通用性,并且相对容易操作。研究人员试图确定SN50是否会减少与强佐剂相关的副作用,并观察这种改变对全身细胞因子的保护作用。研究人员在2017/2018流感季节使用Fluzone四价疫苗注射给小鼠,有无CpG(50μg)作为免疫佐剂,有500μgSN50(SN50H或50μgSN50(SN50 L)作为免疫佐剂免疫增强剂。Fz + SN50组的TNF-α水平低于单独Fz。在所有组中,添加SN50可使TNF-α和IL-6的水平降低至与安慰剂组一致的水平。为了检查SN50是否可以减轻接种疫苗的副作用,研究人员分析了接种后24、48和72小时的体重变化百分比。体重减轻是小鼠副作用最客观的度量,到24小时时,接种Fz和Fz + SN50的小鼠平均损失0.85和0.75%,Fz + CpG组平均损失5.9%。在第72小时,Fz组的体重为起始体重的-1.1%,而接种Fz + SN50的小鼠体重增加了+ 1.5%。Fz + CpG组的体重减轻了起始重量的-1.6%,添加SN50 H导致体重减轻(变化0%),添加SN50 L导致体重减轻了-1.3%。总体而言,具有SN50的小鼠比没有SN50的小鼠体重减轻得更少,这表明SN50降低了与疫苗接种相关的副作用,并提高了疫苗的耐受性。
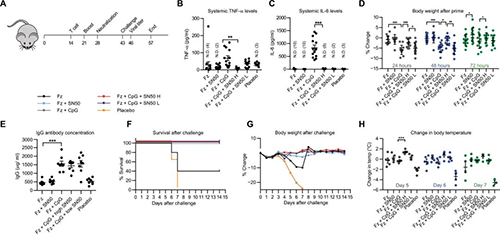
流感挑战模型(来源:Science Advances)
在第28天,研究人员分析了血清中血液中的抗体水平,Fz和Fz+ SN50之间的血清IgG浓度无显着差异,Fz样品和Fz+CpG之间有2.9倍的显着差异。接种CpG的组之间无显着差异,这表明添加SN50可以减轻炎症和疫苗接种的副作用,提高耐受性,同时保持抗体浓度。接下来,研究人员试图确定在疫苗中加入SN50是否会增强对Fluzone的保护。在此阶段没有对小鼠施用任何额外的SN50,因此只有疫苗诱导的适应性免疫反应和随后的加强免疫可以起到保护小鼠免受流感的作用。在Fz+CpG中添加SN50可提供同等的保护,同时可改善初次接种疫苗的副作用和耐受性,在Fz中添加SN50可提供等同于Fz+CpG组的增强保护。这表明SN50除了提高耐受性外,还可以增强疫苗的适应性免疫潜能。
新疫苗佐剂的耐受性和保护性通常被认为是两个具有反比关系的相互依赖的变量,其中通过限制耐受性获得了足够的保护,反之亦然。由于这种增强剂使疫苗既安全又更具保护性,研究人员想要寻求一种单一方法来分析SN50如何改变耐受性和保护性。由于这些变量被认为是负相关的,因此很少有相关的先例。遵循评分系统的先例,研究人员开发了一个容忍度与保护度的关系图,该图仅用作本研究中收集的所有数据的直观表示。在疫苗接种中包括SN50的所有组均增加了耐受性和疫苗保护性。综合所有数据后得出结论,SN50通过增加耐受性和改善疫苗接种的保护效果而充当免疫增强剂。
改善各种TLR和物种的佐剂反应
为了检查SN50在各种TLR激动剂中的作用,研究人员对用SN50处理的RAW巨噬细胞进行了定量聚合酶链反应,然后用不同TLR的激动剂进行刺激。用SN50和脂多糖(LPS;10ng/ml)、CpG(5μg/ ml)、R848(1μg/ml)和Pam3CSK4(100ng/ml)刺激细胞,并将转录水平与TLR激动剂处理的细胞进行比较单独使用。在RAW巨噬细胞中,研究人员观察到TNF-α和IL-6的下调促炎细胞因子转录水平。与单独的激动剂相比,在所有激动剂中细胞表面受体CD86和MHCII转录水平均被上调。这与体内观察结果相吻合,当在SN50与CpG一起使用时,淋巴结内cd86表达增加并且细胞活性增加,这表明增加T细胞反应和增加与T细胞中细胞迁移和细胞毒性相关的基因表达的相同作用对于大多数佐剂将维持不变。
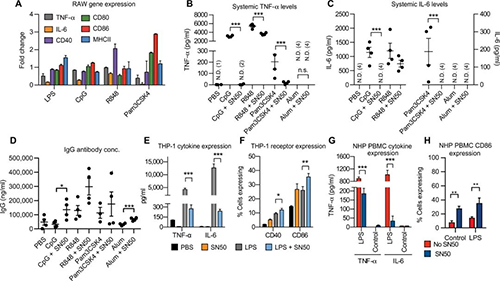
多种佐剂的体内疫苗接种(来源:Science Advances)
为了检查其在体内的翻译方式,研究人员使用gp120作为抗原为小鼠接种了CpG(50μg)、Pam3CSK4(20μg)和R848(50μg),将这些佐剂与最广泛使用的明矾(250μg)一起使用。使用CpG观察到完全消除了全身性TNF-α和IL-6促炎细胞因子,使用R848和Pam3CSK4发现TNF-α和IL-6均显著降低。仅明矾不会引起全身性细胞因子应答,并且添加SN50不会改变细胞因子谱。这些数据表明,SN50在广泛的佐剂上可用于减轻全身性炎症,同时维持提高适应性反应,这证明了该系统对大量免疫佐剂具有广泛的潜在用途。
为了了解这种效果如何转化为人类疫苗,研究人员用含或不含SN50的LPS(1μg/ ml)处理了THP-1单核细胞。用SN50和LPS处理的细胞表达的TNF-α和IL-6水平明显降低,还观察到CD40和CD86的水平增加。用SN50和LPS或单独的LPS刺激了NHP PBMC 6小时,并分析了细胞上清液中的促炎细胞因子,用LPS刺激的细胞在细胞上清液中显示出高水平的TNF-α和IL-6,而具有SN50的细胞则显示出细胞因子水平的显著降低。因此与单独用LPS刺激的细胞相比,用SN50和LPS刺激的细胞中CD86表达增加了两倍,这意味着SN50在NHP和人类中的作用可能与在小鼠中的相似。
结果与讨论
使用广泛的TLR激动剂,在体内和体外均显示NF-κBp50亚基的细胞可渗透抑制剂,增强免疫反应,减少炎症和副作用,同时增加抗体反应。CpG与免疫增强剂的共同给药可导致全身促炎性细胞因子水平显著降低,通常降至无法检测的水平。同时,添加免疫增强剂导致模型抗原OVA抗体的IgG水平增加三倍,这表明有可能增强适应性免疫反应同时限制先天免疫系统引起的炎症。SN50是数百种类似的NF-κB增效剂之一,当与适当的TLR激动剂结合使用时,许多增强剂可用于引发针对不同疫苗或免疫疗法的特异性和潜在可调性反应,该方法有潜力使更广泛的模式识别受体(PRR)激动剂能够安全地用于疫苗中,并扩大可安全施用佐剂的窗口。它还可能增加适应性免疫谱的多样性,并扩大疾病的预防和治疗范围。
总而言之,研究人员已经证明将特定的NF-κB抑制剂与常见的免疫佐剂结合使用可以降低全身促炎性细胞因子的产生,同时提高细胞表面受体的表达,从而在小鼠、人类和NHP原代细胞中有效地呈递抗原并激活T细胞。在体内使用这种抑制剂可将全身性TNF-α和IL-6完全降低至基线水平,同时增加疫苗接种后的下游适应性体液反应。有数百种已记录的免疫佐剂可为疾病提供足够的保护,但是无法独立调节炎症和副作用限制了它们的使用。研究人员预计该框架将使各种TLR激动剂能够安全地用于人类疫苗中,从而增加适应性免疫谱的多样性,并扩大疾病的预防和治疗范围,同时这项研究也可能会有益于新冠疫苗的研发,尤其是当病毒突变成季节性病毒时。美迪西在疫苗的安全性评价等方面积累了多年的经验,对于疫苗的研究也从未停下脚步,美迪西会持续关注此项研究进展,希望可以为疫苗的优化和研发助力。
关于美迪西
美迪西(股票代码:688202)成立于2004年,总部位于上海,致力于为全球制药企业、研究机构及科研工作者提供全方位的临床前新药研究服务。美迪西的一站式综合服务以强有力的项目管理和更高效、高性价比的研发服务助力客户加速新药研发进程,服务涵盖医药临床前新药研究的全过程,包括药物发现、药学研究及临床前研究。美迪西与国内外优质客户共同成长,为全球超过700家客户提供新药研发服务,美迪西将继续立足全球视野,聚力中国创新,为人类健康贡献力量!
联系我们
Email:
marketing@medicilon.com.cn
电话: +86 (21) 5859-1500(总机)












 相关新闻
相关新闻