泛素-蛋白酶体系统(UPS)功能紊乱与多种疾病的发生具有密切关系,包括肿瘤、心血管疾病、神经退行性疾病等。因此,UPS已经成为相关疾病治疗的热门靶点之一。抑制泛素-蛋白酶体系统,调控相关底物蛋白的降解,实现疾病治疗是重要的药物开发策略,目前靶向泛素-蛋白酶体系统的小分子抑制剂研究主要有泛素活化酶E1抑制剂、泛素结合酶E2抑制剂、泛素连接酶E3抑制剂以及蛋白酶体抑制剂等。
TAK-243是一种首创的(First-in-Class)、高效的泛素活化酶E1 (UAE) 抑制剂。研究发现TAK-243具有显著的抗肿瘤活性。其中,科研人员通过美迪西使用HCC-70模型进行体内药效实验。结果发现肿瘤生长抑制率(TGI)达到91%。本篇文章结合文献报道和美迪西药效部门的经验,分享泛素化抑制剂研发的药效研究案例,希望对关注泛素化研究和肿瘤药效的各位科研工作者有所帮助。
泛素化
泛素分子在一系列特殊的酶作用下,将细胞内的蛋白质分解,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程。泛素化在蛋白质的定位、代谢、功能调节和降解中都起着十分重要的作用,也参与了细胞周期、细胞增殖、细胞凋亡、细胞分化、转移、基因表达、转录调节、信号传导、损伤修复、免疫炎症等众多生命活动的调控。
泛素-蛋白酶体系统
泛素-蛋白酶体系统 (Ubiquitin-Proteasome System,UPS) 是细胞内负责蛋白质降解的多组分系统,介导真核生物80%以上的蛋白质降解,参与细胞的生长及分化、DNA复制与修复、细胞代谢、免疫反应等。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)主要由泛素(ubiquitin,Ub)、泛素活化酶E1、泛素结合酶E2、泛素连接酶E3、去泛素化酶(deubiquitylating enzymes,DUBs)和26S蛋白酶体组成。
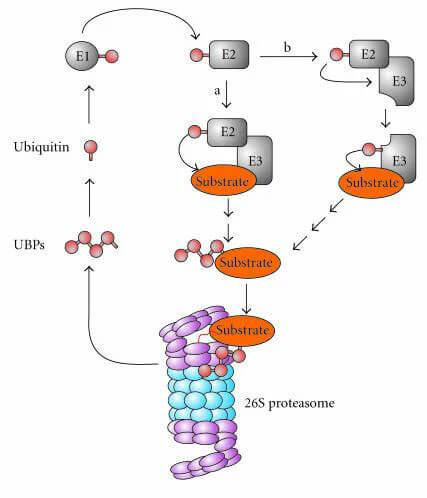
泛素-蛋白酶体系统(UPS)[1]
泛素(ubiquitin,Ub)
泛素是一种广泛分布在真核细胞中的高度保守的小分子蛋白。单个泛素分子由76个氨基酸残基组成。主要功能是标记需要分解掉的靶蛋白,使其被26S蛋白酶体降解。泛素还可以标记跨膜蛋白,参与蛋白质的跨膜运输。
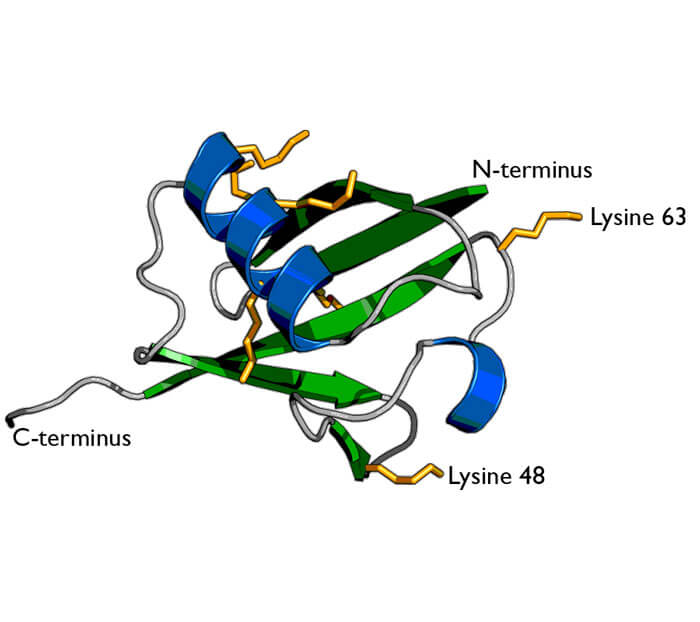
泛素结构图(来源:Wikipedia)
泛素活化酶(E1)
泛素活化酶,也称为E1酶,是泛素与底物蛋白结合所需要的第一个酶,在结构上含有位置固定的保守的半胱氨酸残基,通过半胱氨酸残基与泛素的C端形成高能硫酯键而激活泛素。对于调节泛素稳态和下游泛素化依赖性细胞过程(包括通过泛素-蛋白酶体系统的蛋白水解和选择性自噬)具有重要作用。
泛素结合酶(E2)
在泛素化过程中,泛素结合酶E2发挥非常重要的作用,是其中必不可少的中间环节。泛素结合酶E2是由许多蛋白质所组成的超家族,结构和功能方面都存在多样性。所有的泛素结合酶都含有一个保守结构域——UBC结构域。泛素结合酶 (E2) 将泛素从泛素活化酶 (E1) 转运到泛素连接酶 (E3) 和底物中起关键作用。
泛素连接酶(E3)
泛素化级联反应中的第三个酶,催化将结合在泛素结合酶上的泛素传递给目标蛋白质,泛素连接酶E3决定靶蛋白的特异性识别,在泛素化途径中具有重要作用。泛素连接酶E3通过调控调节蛋白的泛素化过程参与细胞内的多种生理过程。所有的E3都具有连接靶蛋白和特定E2的能力。泛素连接酶E3结构域主要包括HECT结构域、RING结构域和U-box结构域。正是由于这些复杂多变的E3家族成员可以对不同底物进行特异性识别,泛素化途径才呈现出蛋白降解的高度选择性。
去泛素化酶(DUBs)
去泛素化酶家族负责通过水解泛素羧基末端的酯键、肽键或异肽键,将泛素分子特异性的从链接有泛素的蛋白质或者前体蛋白水解下来,起到去泛素化的作用,对蛋白降解进行反向调节,从而影响蛋白质的功能。
蛋白酶体 (Proteasome)
26S蛋白酶体是降解泛素化底物的ATP依赖型蛋白水解复合体,由20S核心颗粒、19S调节颗粒和11S调节因子构成。26S蛋白酶体是泛素介导的蛋白质降解的中心蛋白酶。通过控制参与细胞凋亡、细胞周期和信号转导的关键蛋白的降解,在细胞稳态中发挥重要作用。 蛋白酶体具有多种功能,是药物开发的重要靶标,特别是在肿瘤和神经退行性疾病中。在过去的二十年中已经鉴定了许多选择性蛋白酶体抑制剂并批准用于临床(如:Bortezomib,Carfilzomib等)。
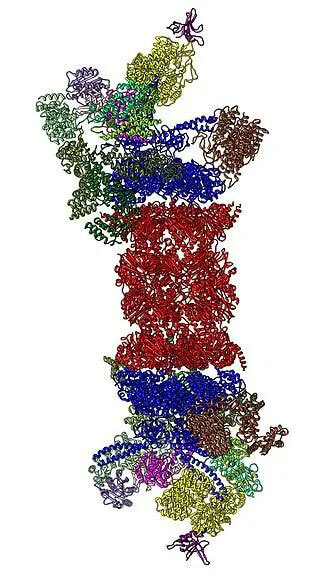
26S蛋白酶体结构(来源:Wikipedia)
泛素化过程
❖ 在ATP供给能量的情况下,泛素活化酶E1将泛素分子活化;形成E1-泛素的中间产物;
❖ 泛素活化酶E1将活化的泛素分子传递给泛素结合酶E2;形成一个E2-泛素的中间产物;
❖ 泛素连接酶E3先识别待降解的靶蛋白,再将结合E2的泛素连接到靶蛋白上,形成一个包含E2-泛素中间产物、E3 酶和靶蛋白的复合物;
❖ E2 酶和E3 酶,从上述的复合物中释放,从而形成被泛素标记的靶蛋白;
❖ 重复上述过程,直到蛋白质上连接的多个泛素形成一条泛素链;
❖ 被泛素化的靶蛋白,被26S 蛋白酶体识别和降解。
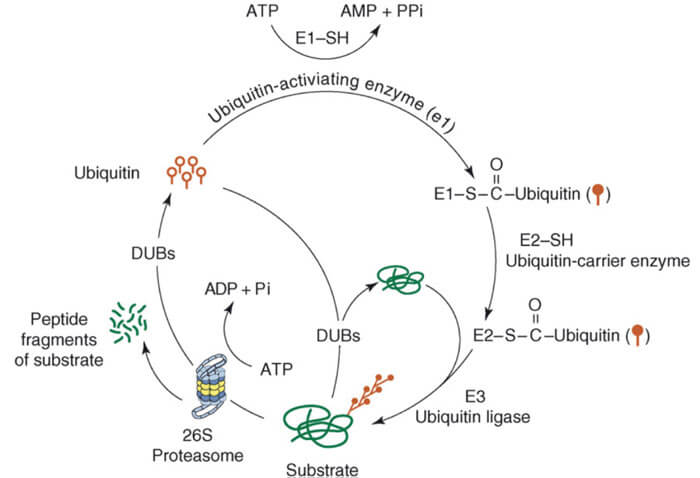
泛素-蛋白酶体途径[2]
泛素活化酶E1抑制剂
哺乳动物中的泛素偶联由两种关键酶启动,即泛素活化酶UAE和UBA6,它们统称为E1酶。UAE(由UBA1基因编码)负责99%以上的细胞内蛋白泛素化,而UBA6负责<1%的泛素化。经典的E1酶均具有腺苷化结构域(AD)、催化半胱氨酸结构域(CCD)以及泛素折叠结构域(UFD)。首先,在ATP和Mg2+存在下,E1酶催化Ub与ATP形成Ub-AMP加合物并结合到E1酶的AD结构域,同时释放是磷酸基团PPi,CCD结构域的半胱氨酸巯基亲核进攻Ub-AMP键形成Ub-E1硫酯键并释放AMP,另一个Ub非共价结合到AAD结构域,形成携带两个Ub分子的E1酶。然后,携带两分子Ub的E1酶结合E2酶,通过UFD将Ub转移到E2酶上,形成Ub-E2复合物,接着参与下一个Ub的活化。因此,抑制E1酶活性能够阻断泛素分子的活化,抑制泛素化过程,是潜在的抗肿瘤靶点。
First-in-Class UBA1抑制剂TAK-243
TAK-243(MLN7243)是由Millennium研发的第一个进入临床的UBA1抑制剂,从超过700个化合物中筛选发现的,能够与Ub形成Ub-TAK-243加合物,进而结合到UBA1的ATP结合位点上,抑制UBA1活性。在多种癌细胞中能够诱导泛素介导的p53、c-Jun、c-Myc、XIAP等蛋白积累并表现出明显的抗肿瘤活性,目前处于治疗晚期恶性实体瘤的一期临床。
TAK-243是一种首创的泛素活化酶 (UAE) 抑制剂。通过形成TAK-243-泛素加合物有效抑制UAE。用TAK-243在体外处理细胞导致细胞泛素偶联物丢失,导致泛素依赖性蛋白质转换和信号传导缺陷,细胞周期进程受损和DNA修复缺陷,蛋白毒性应激增加,最终导致癌细胞死亡。TAK-243在体内治疗肿瘤细胞导致细胞多泛素化急剧减少,并在携带人异种移植肿瘤的小鼠中诱导显著的抗肿瘤活性。
TAK-243具有高选择性,抑制UAE, UBA6, NAE和SAE的IC50值分别为 1, 7,28,850 nM。TAK-243-泛素加合物一旦形成,就会与UAE紧密结合并阻断UAE的催化活性。TAK-243抑制UAE将泛素分子转移到E2酶。
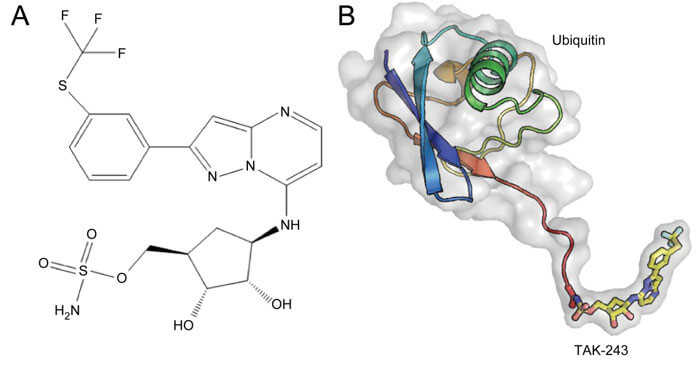
A: TAK-243 的化学结构 B: TAK-243-泛素加合物的结构[3]
TAK-243体内抗肿瘤活性研究
TAK-243的抗肿瘤活性分别通过使用
PDX 和 CDX
肿瘤模型进行研究验证的。8至 12 周龄小鼠的侧腹皮下接种肿瘤碎片或无血清培养基中的肿瘤细胞悬液。科研人员使用 CDX 模型在小鼠中建立了皮下肿瘤:WSU-DLCL2 (弥漫性大B细胞淋巴瘤)、HCT-116(结肠癌)、THP-1(急性髓性白血病)、CWR22(前列腺癌)、Calu-6 (非小细胞肺腺癌)、HCC-70(三阴性乳腺癌)和 MM1.S(多发性骨髓瘤),以及PDX 模型:PHTX-24c(结肠癌)、PHTX -132Lu(原发性NSCLC)、PHTX-55B(三阴性乳腺癌)、PHTX-235O(卵巢癌)和 HNM626(宫颈癌)。
在此项研究中,科研人员通过美迪西使用HCC-70模型进行实验。在每只雌性裸鼠的腹部移植5.0×106 个HCC-70细胞形成HCC-70模型。当平均肿瘤体积达到约 200 mm3时,将动物随机分组,每组 8只动物。在随后的21天时间内按每周两次给药TAK-243(12.5mg/kg) 和对照组 (20% HPβCD)。每周监测两次肿瘤生长和动物体重。最后一次给药后5天内计算TGI。
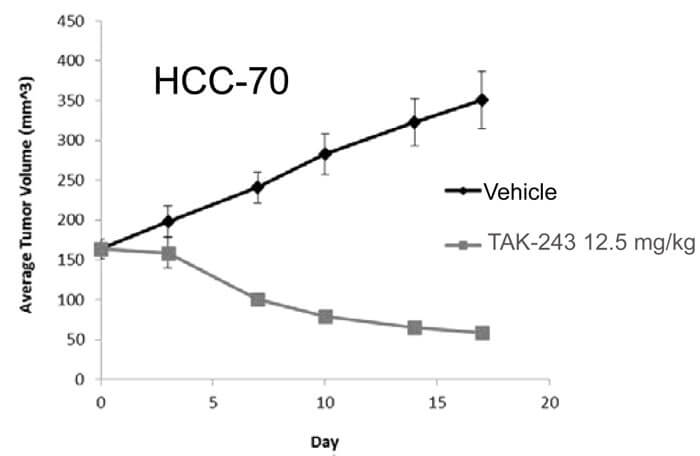
TAK-243对HCC-70的生长抑制曲线[3]
研究发现 TAK-243 在所有检查的模型中都诱导了显著的抗肿瘤活性反应。其中对CWR22、PHTX-235O、HCC-70和PHTX-55B的TGI达到90%以上。同时对动物体重几乎没有影响。
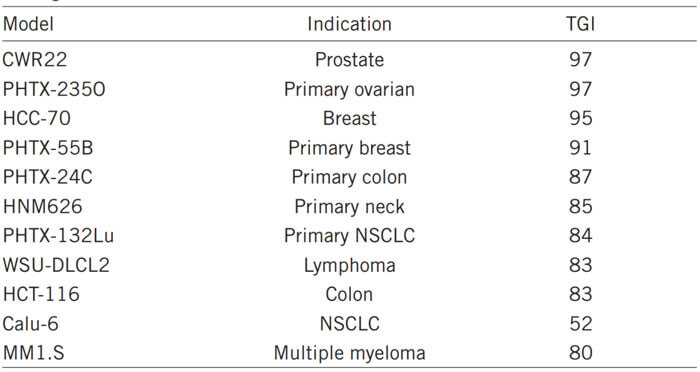
TAK-243体内抗不同肿瘤的活性[3]
总结与展望
泛素在调节细胞蛋白质稳态和信号传导中的不同作用突出了靶向 UPS 调节人类疾病的可能性。尽管有这种潜力,但在 UPS 中涉及的 500多种酶中,只有一小部分是已进入临床研究药物可靶向的。蛋白酶体抑制剂Bortezomib的临床成功引起了人们对 UPS 的其他成分进行研究的兴趣和热情。TAK-243是一种首创的、高效的UAE抑制剂,可完全抑制细胞泛素化,导致泛素依赖性蛋白水解受损、ER 应激以及细胞周期进程和 DNA 损伤修复受损。体内外数据表明 TAK-243 通过UAE抑制发挥其作用。TAK-243的发现为研究蛋白质泛素化提供了一个有价值的工具,并为研究蛋白质稳态和泛素信号传导以用于肿瘤研究提供了新的机会。泛素-蛋白酶体系统是多种疾病特别是肿瘤的重要靶点,靶向该系统会获得更高的选择性。
参考文献
[1] Marie W Wooten, et al. Signaling, polyubiquitination, trafficking, and inclusions: sequestosome 1/p62's role in neurodegenerative disease. J Biomed Biotechnol. 2006;2006(3):62079.doi: 10.1155/JBB/2006/62079.
[2]Ashok N Hegde, et al. The ubiquitin-proteasome pathway in health and disease of the nervous system. Trends Neurosci. 2007 Nov;30(11):587-95. doi: 10.1016/j.tins.2007.08.005. Epub 2007 Oct 24.
[3]Marc L Hyer, et al. A small-molecule inhibitor of the ubiquitin activating enzyme for cancer treatment. Nat Med. 2018 Feb;24(2):186-193. doi: 10.1038/nm.4474. Epub 2018 Jan 15.
[4] Isabella A Lambert-Smith, et al. The pivotal role of ubiquitin-activating enzyme E1 (UBA1) in neuronal health and neurodegeneration. Int J Biochem Cell Biol . 2020 Jun;123:105746. doi: 10.1016/j.biocel.2020.105746. Epub 2020 Apr 18.
[5] H. Yang, X. Chen, K. Li, et al. Repurposing old drugs as new inhibitors of the ubiquitin-proteasome pathway for cancer treatment. Seminars in Cancer Biology. 2021, 68:105-122.
[6] L. Cappadocia, C. D. Lima. Ubiquitin-like Protein Conjugation: Structures, Chemistry, and Mechanism. Chem Rev. 2018, 118(3): 889–918.
[7] J. A. Harrigan, X. Jacq, N. M. Martin, et al. Deubiquitylating enzymes and drug discovery: emerging opportunities. Nat Rev Drug Discov. 2018, 17(1): 57–78.
美迪西药理药效服务
新药研发的突破创新,离不开各种科技平台的强大支持。近年来,药理药效评价、动物模型和基因&细胞疗法等技术不断迭代更新,飞速发展,动物模型已在新药研发进程中发挥着重要作用。不同
疾病动物模型的建立为研究疾病发生与发展机制、筛选和评价抗疾病药物提供了有力的工具。美迪西拥有约30000平方米实验室,通过AAALAC认证,加上充足的动物供应,可以执行小鼠、大鼠、兔、猪、狗、猴等动物的动物模型构建。
美迪西药理药效部紧跟行业发展与市场需求,不断完善创新,经过多年的经验累积,多方验证和长期实践考验,建立了完善的动物模型库,可根据客户的需求提供各种有效的动物模型,用来检测药物的有效性。实验动物有非人灵长类动物、犬、大小鼠、兔、豚鼠、小型猪等种类。
❖ 已建立将近300种肿瘤评价模型,同时我们为创新疗法赋能,全面布局肿瘤免疫疗法的评价和研究,已完成CAR-T,TCR-T, CAR-NK, 溶瘤病毒, 抗体(单抗,双抗,多抗等),siRNA, AAV等免疫疗法的模型建立及药效评价。
❖ 根据客户的需求提供各种有效的动物模型(肾衰模型、贫血动物模型、胃酸分泌动物模型、胃溃疡模型等),用来检测药物的有效性。常规的消化系统疾病有:胃酸分泌、胃溃疡、肾衰等,通过大鼠进行动物实验。
❖ 在代谢性疾病领域具有数十个稳定有效的动物模型,尤其对于临床缺乏有效药物治疗、且近期研发火热的NAFLD疾病领域具有丰富的经验和有效的动物模型。
❖ 为炎症免疫疾病药物的药效评价提供了多种针对不同靶点及通路,稳定可靠,拥有良好评价能力的动物药效评价模型,为新药的临床转化提供助力。
❖ 建立了涵盖抗抑郁药、抗老年痴呆症药、镇静催眠抗焦虑药、镇痛药、抗惊厥药、抗帕金森氏症药以及抗精神分裂症药等众多疾病精神系统疾病模型评价技术,可以从分子水平、细胞水平、Ex-vivo、invivo等多层面全面评价一类创新药物。
❖ 根据客户的需求提供各种有效的动物模型,常规的动物模型有:全层皮肤创伤疾病动物模型、压疮溃疡疾病动物模型、自发性高血压大鼠疾病动物模型等,通过大小鼠、SHR大鼠等进行动物实验。















 相关新闻
相关新闻