前列腺癌是男性中常见的恶性肿瘤,开发用于治疗前列腺癌的有效疗法一直是科学研究的主要焦点。前列腺是一种雄激素依赖性器官,前列腺癌是一种雄激素依赖性疾病。雄激素作用由雄激素受体 (AR) 介导,AR 是一种激素激活的转录因子,AR 属于核受体超家族中的类固醇受体。AR 及其下游信号传导在局部和转移性前列腺癌的发展和进展中起关键作用。
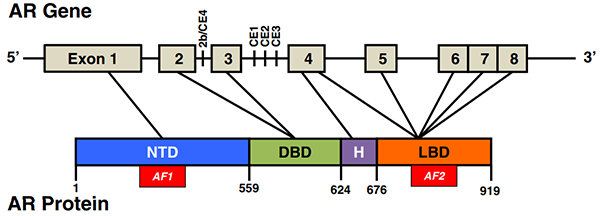
雄激素受体(AR)结构[1]
转移性前列腺癌的主要治疗方法是雄激素剥夺疗法 (ADT)。许多靶向 AR 的药物已被开发用于治疗晚期前列腺癌,包括阻断雄激素合成的 Abiraterone,及与 AR 结合的 AR 拮抗剂 Enzalutamide、Apalutamide 和 Darolutamide。但这些药物通常在治疗后 2 年内出现耐药。在大多数对 AR 拮抗剂耐药的肿瘤中,AR 信号继续发挥作用并驱动肿瘤生长和进展。去势抵抗性前列腺癌 (CRPC) 依赖于 AR。AR 基因扩增、点突变和选择性剪接已被确定为对这些靶向 AR 的药物产生耐药性的一些主要机制。此外,类固醇代谢、细胞信号和辅助调节蛋白的变化也是 CRPC 中 AR 再激活的重要因素。大多数 AR 靶向治疗都针对激素结合域。缺乏激素结合结构域的组成型活性 AR 剪接变体经常在 CRPC 中表达,这一发现强调了开发针对 AR 其他部分的疗法的必要性。所以,迫切需要开发针对 AR 治疗前列腺癌的新治疗策略,特别是针对转移性去势抵抗性前列腺癌 (mCRPC)。mCRPC 到目前为止仍然无法治愈且致命。
靶向降解雄激素受体 (AR)
AR 蛋白的诱导降解在靶向 AR 信号传导方面可能比传统的 AR 拮抗剂更有效。选择性雄激素受体降解剂 (SARD) 与 AR 中的配体结合结构域结合并破坏 AR 与辅助调节剂的相互作用,导致蛋白酶体依赖性 AR 降解。另一种实现诱导 AR 降解的新策略是基于蛋白水解靶向嵌合体 (PROTAC) 技术平台。基于
PROTAC 的 AR 降解剂是一种双功能小分子,由与 AR 蛋白结合的 AR 配体和与 E3 连接酶复合物结合并通过 Linker 连接在一起的配体组成。PROTAC 小分子降解剂已成为一种很有前途的新型治疗剂,但设计具有优异口服
药代动力学的 PROTAC 降解剂是一项重大挑战。在一些研究中,科研人员根据新的策略,设计合成了具有较高口服生物利用度的的高效 PROTAC AR 降解剂。
PROTAC AR 降解剂 ARD-2128
下文中科研人员使用 Thalidomide 募集 Cereblon/cullin 4A E3 连接酶并通过 Linker 进行固化,在小鼠中发现了具有良好口服药代动力学特性的高效 AR 降解剂 ARD-2128。

在此项研究中,科研人员通过
美迪西评估了五种高效 AR 降解剂在小鼠中静脉和口服给药的药代动力学 (PK) 数据,其中最优化合物为 ARD-2128。PK 数据显示,ARD-2128 具有出色的整体 PK 曲线:低清除率 (1.2 mL/min/kg) 和中高稳态分布容积 (V
ss 为2.7 L/kg)。ARD-2128 按 2 mg/kg 剂量静脉给药后的 T
1/2 为 27.6 小时,按 5 mg/kg 剂量口服给药后 T
1/2 为 18.8 小时。ARD-2128 (5 mg/kg) 在小鼠体内达到 67% 的口服生物利用度,通过口服给药有效降低 AR 蛋白并抑制肿瘤组织中的 AR 调节基因,从而有效抑制小鼠肿瘤生长且无毒性迹象。
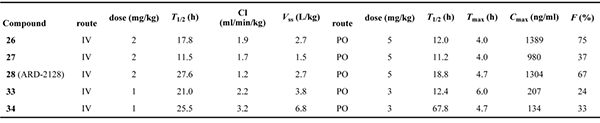
五种化合物在雄性 ICR 小鼠中的 PK 数据汇总[2]
此外,科研人员通过美迪西测试了 ARD-2128 在小鼠、大鼠、犬、猴和人五种属中的血浆稳定性。数据显示,ARD-2128 在所有五种属中都具有稳定的血浆稳定性。

ARD-2128 在五种属中的血浆稳定性[2]
PROTAC AR降解剂 ARD-2585
下文中科研人员报道了一些高效且具有口服生物利用度的 PROTAC AR 降解剂,其中 ARD-2585 是最有潜力的一个。ARD-2585 是一种口服有效的 PROTAC AR 降解剂。ARD-2585 在具有 AR 基因扩增的 VCaP 细胞系和携带 AR 突变的 LNCaP 细胞系中 DC50 值达到 ≤0.1 nM 。ARD-2585 有效抑制 VCaP 和 LNCaP 细胞生长,IC50 值分别为 1.5 和 16.2 nM,并在小鼠中具有出色的药代动力学和口服生物利用度 (51%)。ARD-2585 在抑制 VCaP 肿瘤生长方面比 Enzalutamide 更有效,且不会对小鼠造成任何毒性迹象。所以,ARD-2585 是一种有前途的 AR 降解剂,可用于治疗晚期前列腺癌。

科研人员研究了 ARD-2585 在 VCaP 和 LNCaP 细胞系中诱导 AR 降解的作用机制,发现处理 3 小时后,ARD-2585 (100 nM) 可有效降低 VCaP 和 LNCaP 细胞中的 AR 蛋白。使用 AR 抑制剂、Cereblon 配体 Thalidomide、蛋白酶体抑制剂 MG-132 和 E1 Neddylation 抑制剂 MLN4924 预处理,有效阻断 AR 降解。这些数据提供了明确的机制证据,表明 ARD-2585 通过 Cereblon、蛋白酶体和 neddylation 依赖性机制诱导 AR 降解,因此是真正的 PROTAC AR 降解剂。
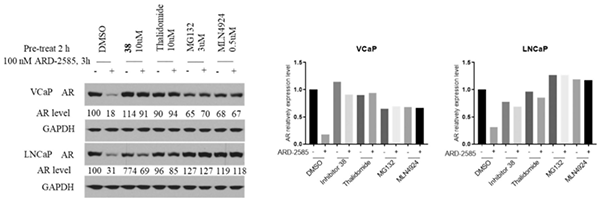
ARD-2585 的作用机制[3]
科研人员接下来测试了 ARD-2585 在 VCaP 异种移植肿瘤模型中的抗肿瘤活性,对照组为 Enzalutamide。ARD-2585 按 10、20 和 40 mg/kg 三种剂量给药均有效抑制肿瘤生长。在治疗结束时 (第 37 天),与空白对照组相比,ARD-2585 抑制肿瘤生长分别达54.9%、74.3% 和 65.9%。相比之下,Enzalutamide (40 mg/kg) 抑制肿瘤生长为 45.0%。所以,ARD-2585 (20 和 40 mg/kg)在抑制肿瘤生长方面比 40 mg/kg 的 Enzalutamide 更有效。同时,ARD-2585 和 Enzalutamide 均具有良好的耐受性,且在整个实验期间均未引起动物体重减轻或其他毒性迹象。
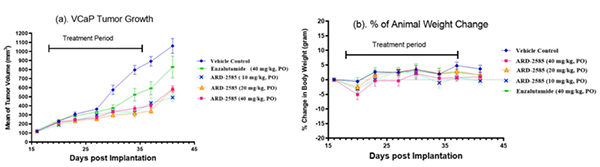
ARD-2585 在 VCaP 异种移植肿瘤模型中的功效[3]
药效学 (PD) 数据还显示,对携带 VCaP 异种移植肿瘤的小鼠单次口服给药 ARD-2585 (20 mg/kg)。肿瘤组织的 Western 分析显示,ARD-2585 在 6 和 24 小时能有效降低 AR 蛋白水平,在 24 小时作用更强。
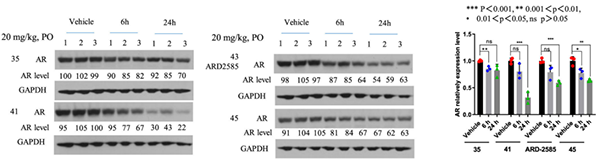
AR 降解剂对 VCaP 肿瘤中 AR 蛋白的药效学 (PD)作用[3]
科研人员评估了ARD-2585在小鼠中静脉和口服给药的药代动力学 (PK)数据,ARD-2585 按 2 mg/kg 的剂量静脉给药后,具有优异的分布容积 (Vss=1.8 L/kg)、长半衰期 (T1/2=5.5 h) 、及低清除率 (Cl=0.3 L/h/kg)。ARD-2585 按 5 mg/kg的剂量口服给药后,Cmax 达到 1140 ng/mL。AUC 达到 8254 h*ng/mL,口服生物利用度为 51%。
最后科研人员通过美迪西对 ARD-2585 进行了全面的代谢测定,包括 ARD-2585 在肝微粒体中的代谢稳定性、血浆稳定性、及 hERG 实验。证实 ARD-2585 在五种不同种属 (小鼠、大鼠、犬、猴和人)具有稳定的肝微粒体中的代谢稳定性和血浆稳定性。T
1/2>120 分钟。人 ERG (人 ether-à-go-go相关基因)通道的体外抑制已被用作评估药物分子潜在心脏毒性的重要试验。科研人员通过美迪西进行了
hERG 实验。测试 ARD-2585 对在 HEK 293 细胞系中稳定表达的 hERG 钾通道电流的体外影响,使用膜片钳技术来确定 ARD-2585 对 hERG 电流抑制的浓度-反应关系。发现 ARD-2585 在高达 30 μM (测试的最高浓度) 下对 hERG 没有抑制作用。
结语
以上研究可用于治疗前列腺癌的口服活性 PROTAC AR 降解剂的开发,并为口服活性 PROTAC 降解剂的设计提供见解和指导。两项研究都借助了美迪西 PROTAC 药物发现技术平台和临床前 DMPK 评价体系。美迪西 PROTAC 药物发现技术平台不仅包含设计合成 PROTAC-POI 和进行 PROTAC-POI 的体外筛选,还能对 PROTAC-POI 进行动物体内药效检测和 PK/PD 研究、药学分析、药物代谢动力学研究和安全性评价,并汇总实验结果和材料进行
IND 申报,以助力客户加快 PROTAC-POI 药物的研发进程。
参考文献:
[1]. AyeshaA Shafi, et al. Androgen receptors in hormone-dependent and castration-resistantprostate cancer. PharmacolTher. 2013 Dec;140(3):223-38.
[2]. Xin Han, et al. Strategies toward Discovery of Potent and Orally Bioavailable ProteolysisTargeting Chimera Degraders of Androgen Receptor for the Treatment of ProstateCancer. J Med Chem. 2021 Sep9;64(17):12831-12854.
[3]. Weiguo Xiang, et al. Discovery of ARD-2585 as an Exceptionally Potent and Orally Active PROTACDegrader of Androgen Receptor for the Treatment of Advanced Prostate Cancer. J Med Chem. 2021 Sep 23;64(18):13487-13509.
美迪西PROTAC药物临床前DMPK评价体系
美迪西 DMPK 团队,通过 PROTAC 技术原理,结合研发案例,利用完善的
体外 ADME、
体内 PK测试平台,在小分子化合物研究基础上,建立起一套关于 PROTAC 药物的筛选和 IND 评价体系,关注药物的溶解度、渗透性、代谢稳定性、代谢产物鉴定与体内 PK 研究等,帮助客户快速推进 PROTAC 药物的研发。


联系我们:
电话: +86 (21) 5859-1500(总机)
















 相关新闻
相关新闻