bDNA技术在寡核苷酸及mRNA药物生物分析中的应用与实例分享
随着技术的不断进步,生物医药蓬勃发展,药物形式多变多样,已经从传统的化药、抗体、蛋白、多肽延伸到细胞、核酸等多种形式。新药物形态的不断涌现,也对相关的生物分析技术提出了高要求和新挑战,新型分析技术也不断被随之引入。美迪西新媒体的生物分析系列专栏,继续邀请本领域的资深专业人员从不同的视角笔谈生物分析,本期将分享核酸类药物的别样分析技术:bDNA。
近年来,核酸药物迎来了其快速发展的阶段。2016年至今,共有 15 款核酸药物成功在美国和/或欧盟获批上市,包括 13 款寡核苷酸药物和2 款 mRNA 疫苗,其中寡核苷酸药物中 8 款为反义核酸药物(ASO),5 款为小干扰核酸药物(siRNA)。可见,以ASO和siRNA为代表的寡核苷酸和mRNA成为了核酸类药物研发的热门细分领域,国内外已有越来越多的寡核苷酸和mRNA进入到了IND或临床研究阶段。
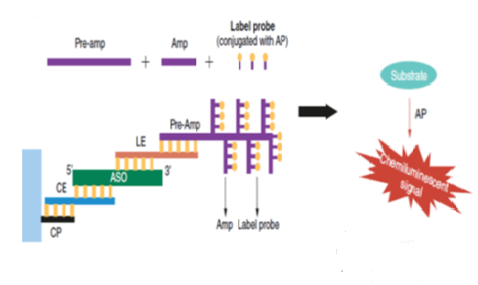
核酸类药物除了涉及合成修饰、递送、稳定性及免疫原性等常见的要考虑和克服的问题外,在进入IND和临床阶段也避免不了药代动力学研究方面的挑战,药代动力学的生物分析方法就是其要面对的一个很现实的技术性挑战。对于mRNA来说,极易被核酸酶降解,不稳定,半衰期短,方法需要高度灵敏。虽然RT-qPCR灵敏度很高且可以执行其定量分析,但涉及复杂的核酸提取和反转录,且核酸提取过程中会有损失、绝对提取回收率不可控等问题;对于寡核苷酸虽然可以通过修饰等技术手段而使不稳定、半衰期短等情况得以有所改善,但其本身分子量不大不小的特性(一般ASO为18-30nt的单链形式,siRNA为20-25nt的双链形式),无论是传统的小分子分析技术质谱还是传统的核酸分析技术qPCR对其分析都具有挑战性,如质谱技术涉及到残留保留、仪器污染及灵敏度问题;Stem-loop RT-qPCR的方法虽然可以勉强用于寡核苷酸,但qPCR技术本身其实更加适合于较长的核酸分子,若是修饰的核酸分子则潜在更不适用。除了质谱和qPCR技术外,液相荧光检测技术及Hybrid-ELISA(hELISA)技术等都在核酸类药物分析上有所应用。这几大类技术形成的方法各有优势,但也各有其劣势,有的需消耗较高的样本量,有的灵敏度仍难以足够高,有的涉及复杂的反应步骤或特殊酶的使用等等局限性。当前还有一种核酸分析技术即bDNA(branch DNA)技术,可以在不同程度上弥补上述各技术的一些不足。bDNA技术即支链DNA技术,该技术综合了分子标记、探针设计、分子杂交、荧光或化学发光检测于一体的分析技术。该项技术的本质是核酸分子杂交技术的升级版,同样需要特异性捕获探针和检测探针。
不过此技术中的捕获探针和检测探针都带有额外的延伸序列,捕获探针可以利用其延伸序列与Assay Plate上预包被的通用捕获序列互补结合;检测探针为双“Z”型特殊结构,其下端与目标分子特异性互补, “Z”型探针上端的延伸部分可以与预放大探针结合,然后由预放大探针、放大探针、标记探针逐步结合构成树枝状结构的探针组实现检测信号的级联放大,从而达到提高灵敏度的效果【图1】。对于较短的小核酸,检测探针的双“Z”型结构可以用非“Z”型的延伸探针灵活替代,只要延伸序列可以与预放大探针互补结合即可。由于预放大探针、放大探针、标记探针都是固定的通用序列,分析所用的微孔板可预包被通用捕获探针,因此这些试剂和耗材可以以试剂盒的形式被商业化提供。目前Thermo旗下的QuantiGene就围绕bDNA技术提供了较为全面的配套固定组成的试剂盒产品,其中已经包含了固定组成的信号放大系统和预包被通用捕获探针的Assay Plate及一些常用试剂,大大便利了科研人员使用这项技术。因此,实践中只要针对具体的目标分子设计、筛选和定制好特异性的捕获探针与检测探针就可以尝试利用bDNA技术为自己的目标分析物开发和优化方法。
该技术克服了传统的Real Time PCR技术中的缺陷与不确定因素,无需抽提纯化RNA,无需反转录,无需PCR扩增,只要将样本用特定裂解液裂解后,经探针杂交与信号放大后即可迅速得到核酸定量结果,每个反应微孔的终末状态样本用量才仅20-40微升即可。bDNA技术在化妆品研发、生物医药及病毒检测等领域中均有应用,此技术在国外医药研发领域应用较为广泛,但目前国内医药研发领域实际应用甚少。由于其高灵敏度且消耗样本量少的特点,在临床前药代动力学和组织分布研究中,尤其是对于那些特殊给药、特殊取材,采样量有限的小动物试验有着独特的应用优势。该项技术可以广泛应用于ASO,siRNA等各种寡核苷酸以及mRNA的检测。Moderna公司就曾用此项技术进行其mRNA产品的生物分布研究。美迪西生物技术药物分析部不仅将该技术成功应用于mRNA产品的分析,而且也成功将其应用到了ASO和siRNA两大最热门的寡核苷酸药物分析中,在国内率先实现了此技术在核酸药物上的全面应用。此文将各结合具体实际案例对此技术的应用进行简要介绍。mRNA是一条单链核酸分子,其长度和碱基数相对于ASO和siRNA要大很多。因此在利用bDNA实现mRNA分析时,其有着寡核苷酸不可与其比拟的优势,因为mRNA长度足够,因此可以对一个mRNA设计多对双“Z”探针,Z型探针越多则信号放大倍数更高,灵敏度就更易提高。
对一个mRNA分子,与ASO和siRNA在该技术利用上所考虑的不同点是,除了基于mRNA序列设计特异的捕获探针和双“Z”型探针外,还需要设计一些与mRNA互补的封闭探针以防非特异性信号的产生【图2】。
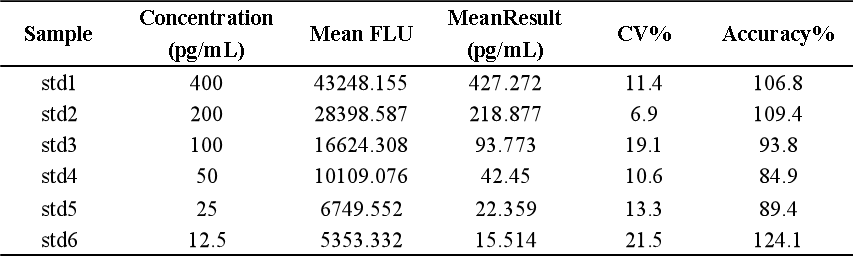
我们基于bDNA技术可以很好地应用于mRNA分析的原理,对某mRNA分子利用bDNA技术开发了其组织分布的分析方法。如下例所示,我们可以利用bDNA技术不仅将组织中mRNA的检测下限做到小于100copies/uL,而且其准确度和精密度都可以完全满足LBA技术的法规所要求接受标准。从标准曲线上可以看出,bDNA技术方法中不同浓度标准品的仪器响应信号的倍增与浓度倍增间的关系趋近了理想的正比例关系【表1】,因此可以做到利用一次方程线性拟合【图3】,因其脱离了抗原-抗体反应关系的利用,故其信号与浓度间的线性关系不同于LBA技术及hybrid-ELISA技术,而后两者往往要用4参数或5参数的曲线进行拟合。表 1 bDNA检测某mRNA的标准曲线数据
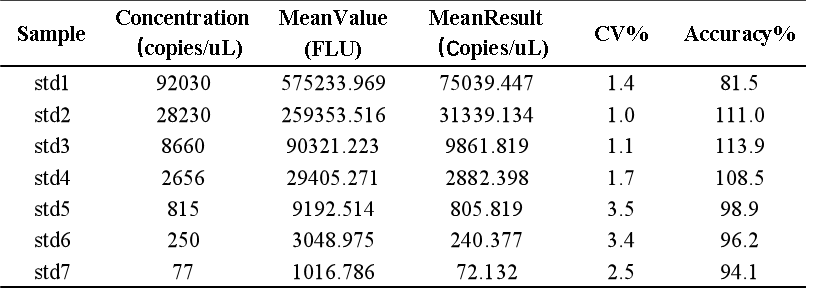
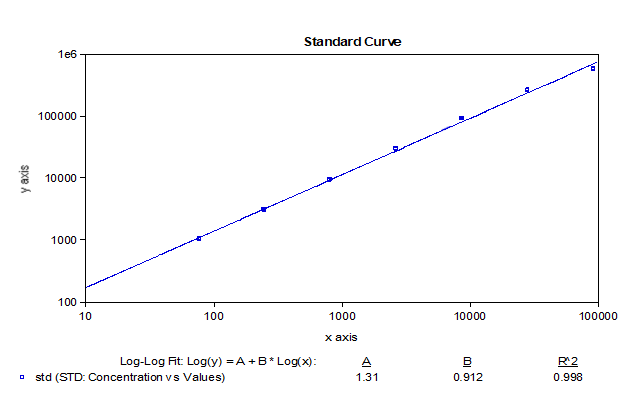
图3 bDNA检测某mRNA标准曲线拟合
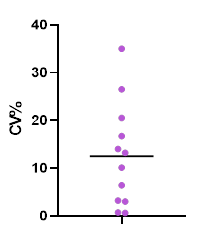
在一项Preclinical study中,第一轮样品分析中的仅极少部分的组织样品因需进行了重分析,而重复分析的结果几乎全部与初次分析结果一致,即90%以上的样品与初次分析结果一致【图4】,显示bDNA技术方法具有良好的重现性。
3. bDNA在反义寡核苷酸(ASO)分析上的应用
bDNA应用于ASO和siRNA时与在mRNA上的应用有所不同,因为前两者是寡核苷酸,链很短而不必要封闭探针,且因为链短而也不方便使用双“Z”型探针,也更不可能使用多个双“Z”型探针进行信号的放大,一般情况下只能用非“Z”型的序列延长探针,例如【图5】所示。因此对于ASO的分析,其难度也相对大于mRNA。
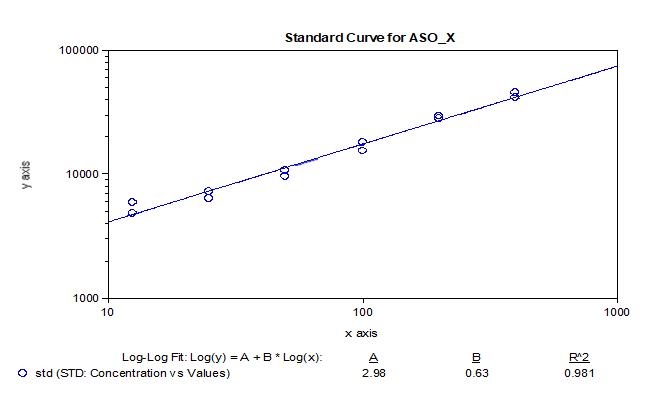
美迪西实验室也将bDNA实际运用到了血浆中ASO的分析,也获得令人满意的灵敏度参见【表2】和【图6】。虽然其bDNA Assay开发和反应条件探索的过程要比mRNA艰辛复杂。而且基于本实验室经验,对于不同的ASO,其反应步骤和反应体系需要灵活变更,虽然目前可以买到含通用探针、Buffer和底物的试剂盒,但不能被其完全局限。
为了适应具体研究的ASO的特性尤其是为避免稳定性和基质干扰的影响,我们需要针对性摸索和替换一些特殊缓冲液或裂解液成分,这些是通用试剂无法提供的。在灵敏度的实现与提高上,我们也基本上认为对于同样的一个小核酸分子,bDNA技术较于Hybrid-immnoassays 相对更容易促进Assay的灵敏度。4. bDNA在小干扰RNA(siRNA)分析上的应用
基于bDNA技术进行siRNA的分析,本质上也是针对其中的一条链构建特异性探针和进行信号放大,反应原理图类似于ASO,因此本文不再单独用图展示,仍可参见【图5】。然而,bDNA在用于构建ASO和siRNA分析方法时也有着很大的区别,ASO是单链,而siRNA是双链结构,因此在bDNA技术应用于ASO要相对于siRNA容易实现;siRNA在利用bDNA技术平台构建分析方法时挑战相对较大,因为siRNA自身双链特征,对于siRNA样品需要多一个变性的步骤,而变性后又要防止在退火杂交时互补链自身的复性结合而影响了捕获探针和检测探针与目标链的结合,这是不同于单链RNA的最大担忧。
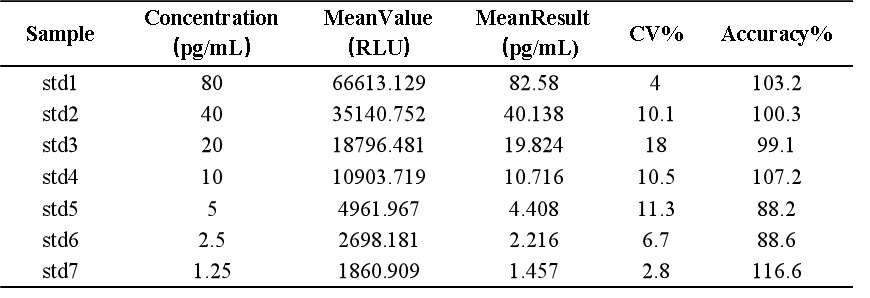
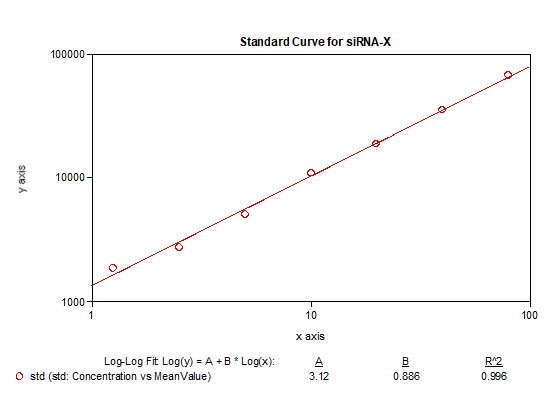
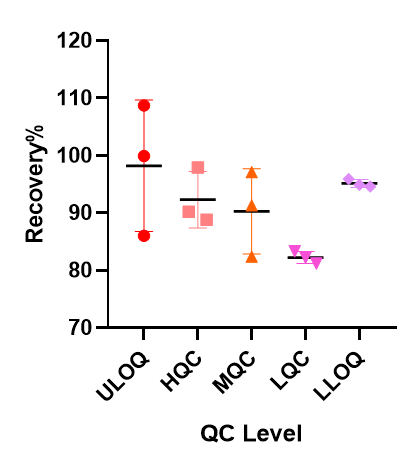
探针序列的选择和退火孵育温度的探索非常重要,另外同样也避免不了稳定性和不同基质的影响,siRNA各反应条件在方法开发中的摸索更加复杂,这些都是此技术应用于siRNA分析实践中的需要个性化克服的重要的挑战。一旦这些基本问题得到克服,也可以开发出很高灵敏度的siRNA分析方法,下面图表即为美迪西实验室基于bDNA技术分析血浆中某siRNA的案例展示,如【表3】所示可以做到个位数的pg级灵敏度,无论是ULOQ(80pg/mL)还是LLOQ(1.25pg/mL)各浓度的不同套质控样品都能达到传统PK分析方法的回收率接受范围【图7】,此灵敏度下的仪器响应值相对不高但仍能执行很好的一次方程线性拟合【图8】。表 3 bDNA检测某siRNA-X的标准曲线数据
对于小寡核苷酸,bDNA除了应用于ASO及siRNA以外,还可以用于miRNA和核酸适配体等各种小核酸分子,应用原理与形式总体与前两者雷同,且miRNA及核酸适配体(一个上市后退市)目前未见正式成药,也就不在此文赘述。
综上所述,bDNA技术是一种可以很好的可广泛应用于各类核酸检测的技术,无论是长的mRNA,还是短的小寡核苷酸,相较于LC-MS/MS或HRMS及Hybrid-immunoassays等系列技术,其相对更容易提升灵敏度。目前基因治疗领域已经有越来越多的核酸药物使用特殊的局部给药方式,常涉及到特殊的取材如脑脊液,小动物尿液、甚至还有一些是活检组织样品。因此,对相关生物分析也提出了高灵敏度低样品消耗的更高的现实需求,也是相关医药研发工作者的现实需求,bDNA恰是满足此类需求一种很好的技术。对于mRNA的分析,传统的RT-qPCR方式虽然可以分析且也有很高的灵敏度,但因核酸的提取步骤繁杂不可能避免抽提过程中核酸的绝对损失,而且不同的提取试剂、人员或提取仪器都会有差异,这些都潜在令qPCR方法的实际灵敏度有所折扣。bDNA技术避免了这些前处理过程的影响,而且可以做到用单位体积目标分析物拷贝数作为其绝对定量单位,且bDNA技术方法一旦开发出来要比qPCR的方法稳健得多,可以用传统的药代生物分析的行业技术接收标准来对此类方法进行约束质控。这是其与qPCR技术有显著区别的地方。基于美迪西生物分析实验室的全面应用和体验,bDNA技术无疑是有显著优势和应用价值的适于医药研发工业领域的核酸检测技术。bDNA虽然是一项比较优越的技术,但是实际应用于各类核酸分子分析中并非是可以一蹴而就的,同样需要较复杂的方法开发和优化过程。同Hybrid-immunoassays一样,这类技术方法高度依赖特异性探针的设计去成就其方法的特异性,在各类探针齐全的条件下仍然要花费较长的时间和精力摸索反应条件及各类反应缓冲液的配方甚至调整不同探针的反应模式、反应体系和反应顺序等系列条件才能开发建立出一套满意适用的分析方法。正如前文指出,bDNA在被利用于各类型核酸分析中,对于mRNA、单链寡核苷酸(ASO)和双链寡核苷酸(siRNA)其应用难度是递进的,而且每一个类型核酸中具体药物分子的bDNA方法也都是个性化的,难度因分子本身而异,需要针对具体分子的序列和特点进行分析方法的开发。在生物分析方法开发上,bDNA技术并没有比其它类型方法显著节省时间和精力,而且bDNA技术因其探针结构特殊性,该方法的应用成本要高于其它核酸分析技术。然而,一旦基于bDNA技术原理的方法开发成功,则具有非常可靠的稳健性和重现性。bDNA技术还可以执行多重检测,其所涉及到的双“Z”型探针或其它延伸探针及信号放大系统不仅可以直接用于核酸的检测,还可以拓展到其它的分析检测平台上。Thermo公司就将这类探针技术运用到流式平台针对细胞层面的转录本检测中,固定并破膜的细胞可直接与特异的延伸标记探针孵育基于信号放大系统进行信号放大,最后被流式检测,此技术被命名为PrimeFlow RNA分析技术。除了在流式平台的拓展应用外,双“Z”型探针及信号放大系统还可以被组织细胞的目标RNA原位杂交RNAscope技术所应用,从而使RNA原位杂交具有高度特异性、提高单分子检测的敏感性并带来极高的信噪比,能够在单细胞水平同步定量多个RNA的表达,在获得单细胞中单拷贝RNA表达数据的同时提供完整的组织形态学信息,这也是小核酸研发领域基于组织学水平考察药物分布所需要的技术。尽管目前在国内医药研发领域bDNA技术的应用相对较少,但随着基因治疗药物尤其是其分支领域核酸类药物的蓬勃发展, bDNA将会逐步走入广大研发人员视野,该技术的性能将被越来越多的人认知和认可。

分享到:












 相关新闻
相关新闻