目前在临床试验中有42种针对COVID-19的疫苗,这些疫苗的类型各不相同,其中包括DNA质粒疫苗、灭活病毒疫苗、腺病毒载体疫苗、RNA疫苗、蛋白质亚单位疫苗和病毒样颗粒疫苗。在早期临床试验中,其中一些已被证明是安全的并能引发免疫反应。目前迫切需要一种针对SARS-CoV-2的疫苗,以防止COVID-19的进一步波动。用BBIBP-CorV免疫可快速诱导针对SARS-CoV-2的免疫反应,这对于预防或限制COVID-19大流行具有重要意义,有必要进行进一步的临床研究,以评估这种疫苗在临床应用中的潜力。
近日,柳叶刀上发表了一篇关于由中国研发的一种新型灭活候选疫苗BBIBP-CorV的安全性和免疫原性的临床试验,研究中使用的BBIBP-CorV疫苗是从一名中国患者身上分离出的病毒样本。该病毒的原种在实验室中使用细胞系进行生长,然后使用一种称为β-丙酸内酯的化学物质进行灭活。
先前的一项临床试验报道了另一种同样基于灭活完整SARS-CoV-2病毒的疫苗的相似结果,但是在该研究中,该疫苗仅在60岁以下的人群中进行了测试。本次研究的作者之一,中国北京生物制品有限公司的杨晓明教授说:“保护老年人是COVID-19疫苗的主要目标,因为这这种疫苗可能会导致严重疾病的风险,由于免疫系统随着年龄的增长而减弱,因此该组疫苗有时效果较差,但令人鼓舞的是,BBIBP-CorV可以诱导60岁以上的人产生抗体反应,因此我们相信有理由进一步调查。”
最新研究包括年龄在18至80岁之间的参与者,并发现在所有接受者中均诱发了抗体反应。60岁及以上的参与者反应较慢,在所有接受者中均检测到抗体需要42天,而18-59岁的参与者则需要28天,这是对人类参与者进行测试的灭活SARS-CoV-2疫苗的首次报导。该试验表明,灭活的SARS-CoV-2疫苗BBIBP-CorV在健康人群中是安全、可耐受和具有免疫原性的。

01 方法
在第1阶段的2020年4月29日至6月28日之间,筛选了466位参与者,并入组192位(男性47%,女性53%;50%年龄18-59岁,50%≥60岁;平均年龄53岁)。18至59岁的小组中有96名参与者,60岁及以上的小组中有96名参与者。在这些组中,随机分配了32名参与者,分别以3:1的比例接受2剂2μg、4μg或8μg疫苗或安慰剂。因此,有144名参与者接受了疫苗,48名参与者接受了安慰剂。分析中包括了他们的安全性数据和现有的免疫原性数据,所有入选患者均无基础疾病。
在第二阶段,即2020年5月18日至7月30日,筛选了546位18-59岁的参与者,并招募了448位参与者(男性45%,女性55%;平均年龄42岁)。所有入选患者均无基础疾病。为了测试8μg抗原在不同组合中的影响,通过单次全剂量或两次剂量的每种均含4μg抗原,将参与者随机分配为在第0天(n = 112)接种8μg疫苗或安慰剂,或在第0和14天(n = 112)、0和21天(n = 112)或0和28天(n = 112)接种4μg疫苗或安慰剂。
02 不良事件
最常见的注射部位不良反应是疼痛,第1阶段的144名疫苗接种者中,有34名(24%)报告疼痛,而48名安慰剂接受者中有3名(6%)。对于18-59岁年龄组(n = 72)的疫苗接种者,除了疼痛另外的注射部位不良反应包括肿胀。对于60岁及以上年龄组(n = 72)的疫苗接种者,除了疼痛另外的注射部位不良反应是硬结。研究人员观察到,在18-59岁年龄组中,与安慰剂组相比有统计学上更高的疼痛报告。
在第2阶段的336种疫苗接种者中,有76名(23%)接种了疫苗后的前7天内至少发生了一种不良反应。疫苗接种者组中最常见的注射部位不良反应是疼痛(336例中的53例[16%]),高于安慰剂组(112例中的4例[4%];p = 0·008)。疫苗接种者组中最常见的系统性不良反应是发烧(336例中的7例[2%])。4μg第0和21天组的一名安慰剂接受者报告3级发烧,但自我康复,所有其他不良反应的严重程度为轻度或中度。
03 结果
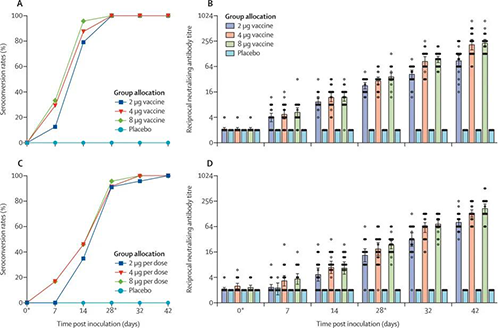
60岁及以上的血清转化率和中和抗体滴度(来源:The Lancet)
在第1阶段对于18-59岁组中的疫苗接种者,2μg组中的24人中有19人(79%),4μg组中的24人中有21人(87%),8μg组中的24人中有23人(96%)在第14天进行血清转换。在第28天,所有三个队列的血清转化率均达到100%。对于60岁及以上年龄组的疫苗接种者,在2μg组中的23人中有8人(4%),在4μg组中的24人中有11人(46%)在第14天对血清进行了血清学转换。其中2μg组中的23人中有21人(91%),4μg组中的24人中有22人(92%)和8μg组中的23人中有22人(96%)在第28天之前进行了血清转换,所有安慰剂接受者的中和抗体在整个试验中均为阴性。
第一次接种后第7天,在143名疫苗接种者中有26名(18%)检测到抗传染性SARS-CoV-2的中和抗体,第二次接种后第42天,检测到中和性抗体上升到100%。在18-59岁年龄组中,到第28天三个疫苗接受者队列中的中和抗体GMT大于安慰剂队列。到第28天,2μg队列中的中和抗体GMT显著低于8μg队列(p = 0·0093),4μg队列中的中和抗体GMT与8μg队列中的无显著差异(p = 0·58)。到第42天,在2μg队列中的中和抗体GMT明显低于8μg队列,在4μg队列中的中和抗体GMT在统计学上与8μg队列(p> 0·99)相当。
在60岁及以上的年龄组中,到第28天疫苗接种者的中和抗体GMT更高。到第28天,在2μg(p = 0·087)和4μg(p = 0·96)队列中的中和抗体GMT与8μg队列中的抗体无显著差异。到第42天,2μg队列中的中和抗体GMT显著低于8μg队列,在4μg队列中的中和抗体GMT与8μg队列(p = 0·30)没有显著差异。
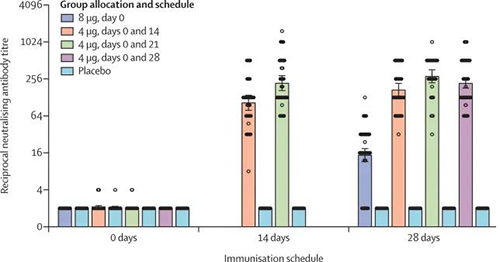
不同免疫方案的中和抗体滴度(来源:The Lancet)
免疫前为0天、14天和28天是指第二次接种后的第14天和第28天,除了8μg第0天组(其中是指单次接种后的第28天)。对于4μg的第0天和第14天以及第0天和第21天组,从该组一半的参与者中收集第14天的样品,从另一半中收集第28天的样品。在第2阶段,在所有四个疫苗接种计划中,中和抗体GMT大于安慰剂队列。到第二次接种后的第0天、第4天和第14天队列中的中和抗体显著低于第0天、第4天和第21天队列中的中和抗体。在最后一次接种后第0天、第8天第28天队列的中和抗体GMT显著低于第0天和14天、0和21天以及0和28天队列的中和抗体(所有p < 0·001)。
04 讨论
在1/2期试验中,BBIBP-CorV灭活疫苗以两剂免疫方式接种,在两个年龄段的所有三个剂量下均安全且耐受性良好。在100%的疫苗接种者中观察到了强大的体液免疫反应。在临床前研究中,研究人员表明用BBIBP-CorV免疫可在小鼠、大鼠、豚鼠、兔和非人类灵长类动物中诱导高水平的中和抗体滴度。本次试验中最常见的不良反应是疼痛和发烧,所有不良事件的严重程度均为轻度或中度。值得注意的是,安慰剂组的全身不良反应数量更高,但是在对呼吸道症状的随访监测中,未检测到上呼吸道感染。在实验室测量中也没有临床上明显的异常变化,也没有任何与疫苗有关的变化。
BBIBP-CorV具有免疫原性,可快速诱导强大的体液反应。对于60岁及以上的患者以及先前患有呼吸道疾病或心血管疾病的患者,COVID-19表现出严重疾病和死亡的极高风险。在该试验中,研究人员旨在评估BBIBP-CorV在60岁及60岁以上患者中的安全性和耐受性。18至59岁年龄组的血清转化率比60岁以上年龄组的血清转化率更早。第一次接种疫苗后(第14天),年龄在18-59岁的人群中有超过75%的患者进行血清转化,其余的疫苗接种者在第28天进行血清转化。对于60岁及以上的年龄组,4μg和8μg剂量接受者的血清转化率在第28天达到100%,而2μg组在第42天进行血清转化,60岁及以上年龄组的中和抗体强度低于18-59岁年龄组。BBIBP-CorV诱导的中和抗体可以中和多个SARS-CoV-2菌株,这些发现表明,BBIBP-CorV具有针对其他SARS-CoV-2菌株提供交叉保护的潜力。
该研究结果的解释受到随访时间短的限制,另一个局限性是缺乏对儿童和青少年的安全性和免疫原性测试。尽管这是该试验原始计划的一部分,但在完成对成人组的全面分析之前,研究人员表示不会开始对18岁以下的人群进行测试。总之,研究人员发现灭活SARS-CoV-2的疫苗BBIBP-CorV在健康人群中具有耐受性和免疫原性。首次接种后第4天开始观察到针对SARS-CoV-2的快速体液反应,第42天在所有参与者中发现100%血清转化。第0天和第21天以及第0天和第28天的两次免疫方案引发了更大的中和抗体。接下来仍然会进一步研究这种灭活疫苗以控制和预防COVID-19,与此同时正在进行的1/2期和3期试验将提供有关BBIBP-CorV的安全性、免疫原性、剂量和免疫计划的更多信息。
关于美迪西
美迪西(股票代码:688202)成立于2004年,总部位于上海,致力于为全球制药企业、研究机构及科研工作者提供全方位的临床前新药研究服务。美迪西的一站式综合服务以强有力的项目管理和更高效、高性价比的研发服务助力客户加速新药研发进程,服务涵盖医药临床前新药研究的全过程,包括药物发现、药学研究及临床前研究。美迪西与国内外优质客户共同成长,为全球超过700家客户提供新药研发服务,美迪西将继续立足全球视野,聚力中国创新,为人类健康贡献力量!
联系我们
Email:
marketing@medicilon.com.cn
电话: +86 (21) 5859-1500(总机)











 相关新闻
相关新闻