



业务咨询
中国:
Email: marketing@medicilon.com.cn
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




当今,在这四海八荒“大众创业、万众创新”的大势之下,药品行业似乎也正在融入这盛世当中。然而,虽仿制药的研发似进入其发展规律中的“天劫”,但这并不意味着创新药物将被那传说中的72只五彩鸟萦绕而起,毕竟“firstinclass”的产品需要一点一滴的历经各种“劫难”而生。不过,借此洪泽,深耕于创新药物开发,打下更为牢固的基础,相信还是极好的事情。今天,在下斗胆在此浅谈一下,创新药物开发过程中,关于“前药”的些许思路。
前药(prodrug),一词最早由AdrienAlbert于1958年提出,当时是用来描述某个经生物转化后可产生具有药理作用的化合物所引用的概念。一直以来,前药被定义为本身无活性,但可转化成一个或多个活性代谢产物的化合物。直到后来,Rautio等又进一步完善了前药的定义,即:在体内经过酶或化学作用释放出可达到预期药理活性的母体药物分子的可逆性衍生物。这里需强调的是,前药没有活性或活性较母体药物小得多。前药设计在克服药物用药障碍、增强化学及代谢稳定性、提高水溶性或脂溶性、增加口服或者局部给药的吸收度、增强血脑屏障渗透性、延长作用时间、提高生物利用度,以及减轻不良反应等应用中,已经成为一种被广泛接受的有效策略。
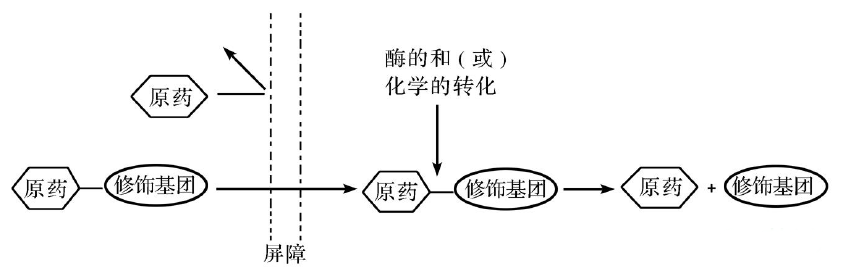
一旦选择前药作为研究方向,接下来将面临其设计及开发等一系列具体问题的挑战。理论上,在设计一个合理的前药分子时,一定要清楚前药可能会改变药物原来的组织分布、功效和毒性。设计前药分子结构时,对于母体药物,哪些官能团可以被有效修饰?对于修饰基团,引入的修饰基团又是否安全?在体内能否被快速清除?病情、用药剂量及疗程情况到底怎样?对于原药和前药,它们的吸收、分布、代谢、排泄等药代动力学信息和特征到底是怎样的?对于分解副产物,它们是否会影响原药化学和物理学方面的稳定性?是否还会生成新的分解副产物?等等等等……都需要药学工作者去一一了解以及攻克!
通常,简单的前药设计,母体药物分子中的各种官能团均有可能成为被修饰的对象。例如,含有羧基和羟基的化合物可修饰为酯类(如羧酸酯和磷酸酯等)前药;含氮化合物可修饰为酰胺、亚胺、N-Man-nich碱、N-酰氧烷基衍生物、Schiff碱、肟和烯胺酮等前药;含羰基化合物可修饰为Schiff碱、肟、唑烷、噻唑烷和烯醇酯;等等等等……当然,这需要建立在清晰的药物代谢信息的基础之上。
首先,是改善药物的水溶性。水溶性差是限制药物口服吸收的重要原因,也是药剂学者经常面对的挑战。药物经过修饰形成前药后一般具有带电基团(如酯类前药中的磷酸酯、单琥珀酸酯、氨基酸酯及二甲氨基乙酸酯等)或亲水基团(聚乙烯-乙二醇共聚物及PEG等)。需要注意的是在增加前药水溶性时需要协同考虑前药的脂溶性,脂溶性太差的前药不能提高口服吸收。在这里,强调下几种载体。磷酸酯类载体通常具有良好的溶解性、化学稳定性外以及适用于静脉注射与口服给药;而氨基酸或多肽类前药载体在此基础上,还可广泛用于各种胺类和醇类药物的结构修饰且口服生物利用度较高;另外,糖苷类载体除了能提高药物水溶性外,有些糖苷能起到一定的靶向作用。
其次,是改善药物的脂溶性。低水溶性是药物生物利用度低的原因之一,但是高水溶性而脂溶性很低也影响其成药性。药物经口服进入胃肠道后需要通过小肠黏膜才能进入人体循环,只有具有一定的脂溶性才能被吸收。脂溶性对中枢神经系统药物尤其重要,药物只有通过人体血脑屏障并达到一定的浓度才能发挥作用,脂溶性与渗透性是关键参数。通过增加药物脂溶性、提高渗透性,以及改善脂水分配系数而提高小肠的被动吸收与血脑屏障穿透率是最常用的前药设计策略之一。
再次,是改善肝脏与小肠的代谢。肝脏和小肠的首过作用是药物口服吸收的重要生理屏障,通过改变药物代谢的途径来减缓代谢,能显著改善药物的药代动力学特征,其主要方法是将容易被代谢的基团通过适当的修饰加以保护。这类前药,虽仍可以被血液、肝脏、肺及其他组织中的乙酰胆碱酯酶降解,但却明显延长了药物的作用时间。
最后,是改善药物的靶向性。前药是母药分子不活泼的衍生物,在体内能自发的或通过某些酶降解释放出有活性的母药。因此,能通过改变靶器官的pH值和某些酶的活性来实现母药的定位释放。如动物实验研究发现,甘氨酸-水杨酸前药在胃肠道上部被吸收,并进入体循环;但谷氨酸-水杨酸前药因为载体氨基酸的亲水性较好,因此,通过膜的量减少,在胃肠道上部很少被吸收,是一个较好的结肠靶向释药系统(口服结肠靶向是前药靶向释药系统中的主要应用)。
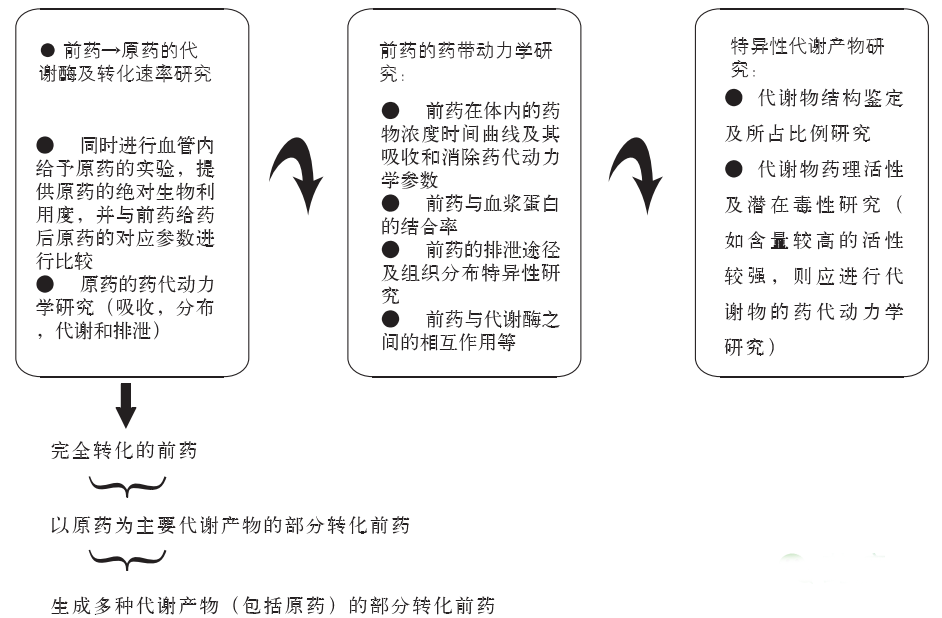
前药在体内转化成活性成分的速度和程度是其发挥药效作用的关键。对于不同类别的前药,首先必须进行二个方面的研究。一是前药的稳定性研究,包括前药的化学稳定性和代谢稳定性研究两部分。前药的化学稳定性研究即考察前药在不同pH值缓冲液(如人工肠液或胃液)中的稳定性;而前药的代谢稳定性研究即为前药转化为原药的研究,包括转化过程中涉及的代谢酶及转化速率研究。例如许多前药是经由血浆或组织中的酯酶如碱性磷酸酯酶、羧酸酯酶等水解为原药后发挥作用,因而对前药在不同种属间血浆和组织中稳定性的考证成为研究这类前药代谢性质的一个重要方面。
一般来说磷酸酯类前药稳定性较好,在体内经由肝肠中的磷酸酯酶水解后迅速转化为原药,并且磷酸酯类前药在不同的临床前物种间的水解速率近似;而对于经由羧酸酯酶水解的前药,由于羧酸酯酶在啮齿类动物血浆中含量较高,因而此类前药在不同种属间会表现出明显的水解速率差异。由于种属差异的存在,前药在不同种属体内的转化速率可能存在很大的差别,而临床前药代动力学结果可能不能反映人体的药代动力学特性,因此采用体外模型进行前药的人体药代动力学特性预测至关重要。
二是对于不同给药方式的前药,应在临床前整体动物试验水平上尽可能同时进行血管内给予原药的试验,提供前药给药后体内原药的绝对生物利用度;并且为了证明前药的药效、药剂或药代动力学性质确实优于原药,在试验设计上应尽可能提供原药对照组的药代动力学参数,即给出与前药等摩尔剂量的原药给药后原药在体内的吸收和排泄情况,与前药给药后原药在体内的相应参数进行比较。
在新药的创制过程中,药学工作者将面临诸多方面的挑战,而是否选择前药来作为开发方向,这就是一个挑战。前药策略虽能改善药理活性化合物的物理化学、生物药剂学、药代动力学性质,以及增加药物研发的可靠性和有效性等等,但由于前药的研究涉及到不同于“正常”药物诸如合成、药效、药代及毒理等方面的研发过程,故而必须慎重选择。不过,前药也正是凭借其优于原药的溶解性、化学稳定性、口服吸收性、代谢缓慢、脑部渗透适当、较小的副作用/毒性等特点,也越来越受到制药公司和科研机构的青睐。其实,不论哪种类型药物的开发,只要能寻找到那安全、有效、质量可控的创新药物,便都是极好的事情,正所谓“三月春盛,烟烟霞霞,灼灼桃花虽有十里,但一朵放入掌心,足矣”。
参考文献:
1. Tomi J,Jarkko R,Mar M,et al. Design and Pharmaceutical Applications of Prodrugs [J]. Wiley,2005.
2. Kristiina MH, Jukka L, Jouko V,et al. In vitro and in vivo evaluation of a sulfenamide prodrug of basic metformin [J].JOURNAL OF PHARMACEUTICAL SCIENCES,2012.
3. Paul WE,Rahul K,Jeffrey G,et al. Prodrugs:Strategic Deployment,Metabolic Considerations,and Chemical Design Principles [J].BURGER'S MEDICINAL CHEMISTRY AND DRUGDISCOVERY,2010.
4. Han VW,Bernard T. Prodrugs[B]. DRUG BIOAVAILABILITY: ESTIMATION OF SOLUBILITY,PERMEABILITY,ABSORPTION AND BIOAVAILABILITY,2009.
5. Testa B,Mayer JM. Introduction: Metabolic Hydrolysis and Prodrug Design[J]. Verlag Helvetica Chimica Acta,2006.
6. 朱胤慈,孙建国,彭英,等. 前药的药代动力学研究进展[J].中国临床药理学与治疗学,2012.
7. 操锋,平其能,陈军.口服前药研究:机遇与挑战[J]. 药学学报,2008.